
ALDEHYDES ET CETONES
3.2- Enolisation et réactions apparentées
Le terme d'aldéhyde provient de leur filiation aux alcools, alcool déshydrogéné. Celui de cétone est dérivé de acétone, premier membre de la série.
|
TRIVIAL NAME SYSTEMATIC NAME |
b. p. (°C) |
|
|
|
Formaldehyde |
Methanal |
H-CHO |
-21 |
|
Acetaldehyde |
Ethanal |
CH3-CHO |
+21 |
|
Propionaldehyde |
Propanal |
CH3-CH2-CHO |
49 |
|
n-Butyraldehyde |
Butanal |
CH3(CH2)2-CHO |
73 |
|
n-Valeraldehyde |
Pentanal |
CH3(CH2)3-CHO |
102 |
|
iso-Valeraldehyde |
3-Methylbutanal |
(CH3)3-CH-CH2-CHO |
92,5 |
|
Benzaldehyde |
|
C6H5-CHO |
1 79 |
|
Dimethyl cetone (Acetone) |
Propan-2-one |
CH3-CO-CH3 |
56 |
|
Ethyl methyl cetone |
Butan-2-one |
CH3-CO-CH2-CH3 |
79.6 |
|
Diethyl cetone |
Pentan-3-one |
CH3-CH2-CO-CH2-CH3 |
101,5 |
|
Methyl phenyl cetone (Acetophenone) |
C61-15-CO-CI-13 |
202 |
|
|
Diphenyl cetone (Benzophenone) |
C6H5-CO-C6H5 |
49 |
|
Noter les dénominations particulières comme - aldéhyde formique = formaldéhyde, aldéhyde acétique = acétaldéhyde, etc ...... - CH2=CH-CH=O acroléine

Noter la dénomination des groupements
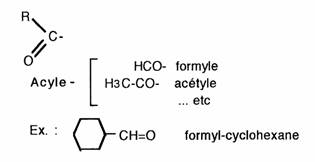
In troduction d'un carbonyle permet la formation de liaison intermoléculaires. Ainsi, seul le formaldéhyde est gazeux à la température ordinaire, la plupart des autres composés sont liquides, les dérivés de haut poids moléculaire sont solides. Ces composés sont en outre très inflammables et présentent souvent une odeur caractéristique.
Le groupement carbonyle est hydrophile

Les premiers dérivés (jusqu'à CS) sont donc solubles dans l'eau et les alcools (liaisons hydrogènes). Tous les dérivés sont, de plus, solubles dans les solvants organiques. L'acétone est donc un solvant miscible à l'eau, l'éther, le chloroforme, les huiles c'est à dire la majorité des solvants usuels.
Nombreuses, catalysées par les acides.
Le formaldéhyde se polymérise en paraformaldéhyde:

Le paraformaldéhyde chauffé vers 200°C libère du formaldéhyde gazeux bactéricide, ce qui est utilisé pour la désinfection des locaux et des instruments.
De la même manière l'éthanal conduit à deux trimères isomères entre-eux:

Le métaldéhyde est responsable d'intoxications fréquentes chez les animaux domestiques (cf. toxicologie).
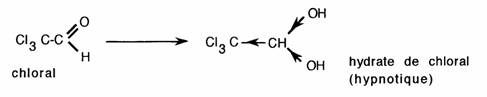
Le gem-diol formé n'est stable que dans certains cas particuliers: ici effet attracteur des chlores.
De la même manière un alcool R OH conduit à des hémiacétals et à des acétals stables en milieu basique uniquement.

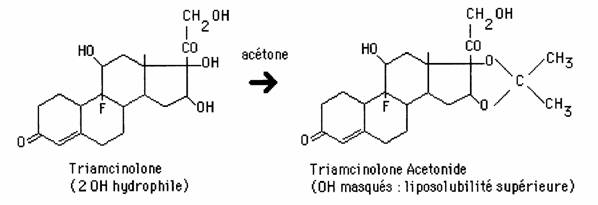
La réaction est utilisée pour masquer les fonctions carbonyles ou alcools:
- au cours d'une synthèse: protection en milieu OH-, restitution en milieu H+
- lors de l'absorption d'un médicament, Ex:
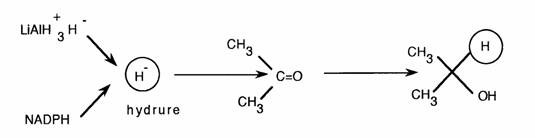
Réduction chimique (hydrure de lithium aluminium: Li Al H4) ou biologique (réductases cytosoliques à NADPH) = même mécanisme
Elle est suivie le plus souvent d'une perte d'eau comme le montre le cas des amines. La fonction imine (-CH=N-) ainsi formée est instable si elle n'est pas conjuguée à un cycle aromatique; les produits obtenus sont généralement colorés et portent le nom de bases de Schiff.

Applications:
- Le formaldéhyde tiendrait son pouvoir désinfectant de son affinité pour les groupements aminés libres des protéines
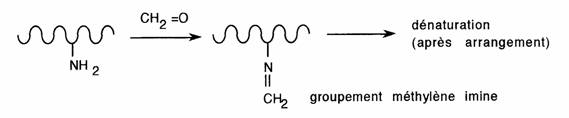
- Le diméthylaminobenzaldéhyde est un réactif coloré des amines aromatiques utilisé par la Pharmacopée (sulfamides, certains anesthésiques locaux ...)
De la même manière l'hydroxylamine (NH20H) conduit aux oximes: -CH=NH+-OH. Celles-ci sont des réactifs nucléophiles puissants en raison de la répulsion des doublets de l'oxygène par ceux de la liaison C=N.
Application: La pralidoxime est utilisée pour réactiver l'acétylcholinestérase phosphorylée par les insecticides organophosphorés (cf. toxicologie).
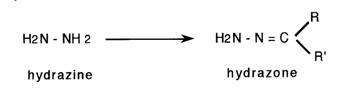
Enfin, l'hydrazine et ses dérivés conduisent à l'hydrazone et ses dérivés correspondants.
Réaction caractéristique de tous les composés carbonylés présentant un H en a du C=O; l'énolisation est catalysée par les bases et par les acides. Elle rend compte des réactions de condensations aldolique ou cétolique.

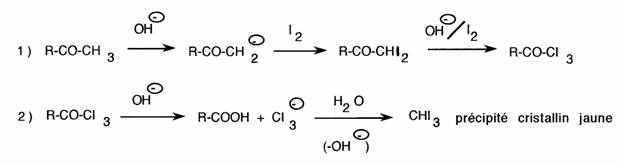
Plus intéressant d'un point de vue analytique, la réaction de l'haloforme permet de caractériser les substances médicamenteuses possédant le groupement carboxyméthyl: -CO-CH3
Les aldéhydes sont extrèmement sensibles à l'oxydation, les cétones le sont un peu moins mais réduisent facilement la liqueur de Fehling (tartrate de cuivre en milieu potassique) et le réactif de Tollens (nitrate d'argent ammoniacal = NH40H + N03Ag).
Cette oxydation conduit à la
formation d'acide carboxylique. Le composé formé présente alors des propriétés
souvent très différentes de la molécule de départ (perte d'activité des médicaments).
L'addition d'antioxydants aux substances
médicamenteuses carbonylées est donc systématique.
L'oxydation à l'air de la vitamine C explique par exemple la faible durée de garantie des teneurs en vitamines figurant sur les aliments.
Les aldéhydes et les cétones peuvent être réduits en
alcools, plus stables.
Application: la streptomycine (antibiotique de la famille
des aminosides contenant du streptose) n'est plus
commercialisée car trop facilement oxydable, cette oxydation aboutissant à une
inactivation de la molécule. Elle est remplacée par la dihydrostreptomycine,
forme réduite, beaucoup plus stable.
Les composés carbonylés subissent facilement une rupture homolytique conduisant au radical acyl stabilisé par résonnance.
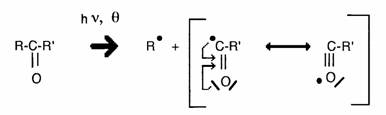
Le radical formé peut également se trouver stabilisé par un réarrangement supplémentaire, ex.
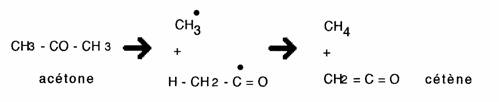
De telles réactions expliquent la sensibilité des composés stéroïdes cétoniques à la chaleur et à la lumière.
Les quinones présentent des réactions radicalaires tout à fait particulières qui leurs permettent de prendre part dans de nombreuses réactions biologiques d'oxydoréduction. Le couple rédox mis en jeu est le suivant:
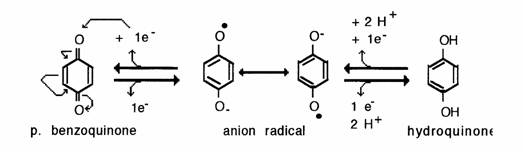
Aldéhydes et cétones peuvent
être réduits ou oxydés sous l'actions de différents systèmes enzymatiques NADH,
NADPH, ou FADH dépendants:
- aldéhydes déshydrogénases, NADH dépendantes,
conduisent à la formation d'acide carboxylique,
- aldéhydes déshydrogénases, FADH et Mo dépendantes, conduisent à la formation d'Ac. carboxylique,
Cf. pour exemple la biotransformation
de l'éthylène glycol
- aldéhydes et cétones réductases, NADPH dépendantes,
conduisent à la formation d'alcools.
Rappelons que quinones et quinones imines
peuvent générer des métabolites toxiques (cf exemple
du paracétamol)
- Le formol et ses dérivés sont utilisés comme BACTERICIDES:
- soluté officinal de formaldéhyde à 35 % (liste 2): il est réservé aux instruments (utilisé à 10 %) en raison de son action irritante.
- Trioxyméthylène (CH20)3: trimère solide du formaldéhyde. Stérilisation du matériel chirurgical par dégagement de HCHO.
- Héxaméthylène tetramine (Méthamine): produit de condensation entre l'ammoniac et le formaldéhyde; se décompose in vivo (urine) - antiseptique des voies urinaires.
- Les aldéhydes et cétones administrables par voie générale ont des PROPRIETES DEPRESSIVES sur le système nerveux central:
- le paraldéhyde (trimère de l'éthanol) est abandonné.
- le chloral Cl3C-CHO sous forme d'hydrate peut être encore employé comme anesthésique (IV) en médecine vétérinaire.
- les propriétés sédatives de l'Acétophénone se retrouvent dans les Butyrophénones (utilisées comme "anesthésiques" ou neuroleptiques).
- Les aldéhydes aromatiques sont caractérisés par leurs PROPRIETES ODORANTES certains sont utilisés comme aromatisants Ex. Benzaldéhyde (odeur d'amande amère).
- Enfin un grand nombre de substances médicamenteuses possèdent des groupements C=O qui représentent autant de poles hydrophiles jouant un rôle dans leur mécanisme d'action et leur pharmacocinétique.