
ALCOOLS


L'introduction d'un hydroxyle
augmente fortement la cohésion intermoléculaire (liaison hydrogènes),
les premiers composés sont ainsi des liquides volatils et
inflammables ( l'inverse des hydrocarbures qui étaient gazeux).
Le point d'ébullition augmente avec l'allongement de la chaîne
mais diminue avec sa ramification.
L'introduction d'un hydroxyle augmente
également la polarité des composés, les alcools sont des composés hydrosolubles
ou amphiphiles
- pôle hydrophile = fonction alcool (la polarité de O-H autorise la formation de liaison hydrogène avec les molécules d'eau).
- pôle hydrophobe = chaine hydrocarbonée.
Les polyols
sont évidemment plus hydrophiles (Mannitol), tandis que la solubilité dans
l'eau décroît au contraire le long de la série des monoalcools: les plus gros
sont insolubles dans l'eau ou présentent un pouvoir détergent (les alcools
cétylique et stéarique sont des émulsifiants).
Les alcools sont des solvants
polaires très appréciés (extraction des drogues, purification des
antibiotiques, préparation de formes galéniques,...). Le méthanol est préféré à
l'éthanol car il peut être purifié en une seule distillation; c'est cependant
le plus toxique des alcools (cécité).
La réactivité des alcools tient compte du clivage de la liaison O-H et de celui de la liaison C-O auxquels on doit ajouter une très nette sensibilité à l'oxydation.
- Acidité: toujours très faible (pKa = 14-16), mais variable dans l'ordre suivant en raison de l'effet inductif des chaînes latérales:

cette acidité ne s'exprime pas in vivo, les alcools sont des composés neutres. Elle est en revanche révélée par exemple au cours de la réaction avec les métaux alcalins

Application: l'éthylate est une base très forte utilisée comme réactif ou catalyseur:
- dans la synthèse des éthers (selon WILLIAMSON):
![]()
- dans la synthèse malonique:

- Estérification: (catalyse acide) par des acides minéraux (sulfurique, phosphorique, nitrique..) ou organiques (carboxyliques). La réaction est facilitée par l'emploi de chlorure d'acide (R-CO-CI) ou d'anhydride d'acide (R-CO-O-CO-R).
Exemples:

Applications: l'estérification est utilisée en pharmacie pour modifier les propriétés de solubilité des principes actifs, retarder leur activité (latence correspondant au temps nécessaire à l'hydrolyse de l'ester) ou masquer un goût particulier. Cette réaction est également réalisée par des enzymes bactériennes et est à l'origine de phénomènes de résistances acquises aux antibiotiques.

- Etherilication

- Déshydratation

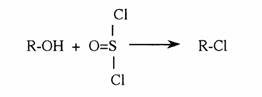
- Synthèse de dérivés halogénés
Par les hydracides halogénés (HX) ou le chlorure de thionyle (SOCl2)
Formation d'aldéhydes ou de cétones puis
d'acides carboxyliques par déshydrogénation
catalytique (Cu-300°C) ou oxydation chimique (Cr207K2 ; Mn04K)
Application:
identification des esters et alcools par décoloration du permanganate de
potassium
Les
alcools sont moins sensibles à l'oxydation que les aldéhydes et les cétones,
mais ils réclament cependant comme eux certaines précautions de conservation
(réfrigération, antioxydants, ... )
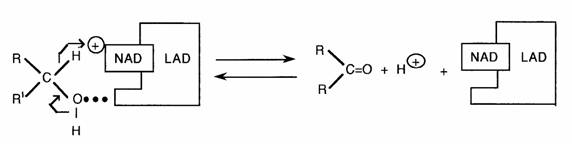
La fonction alcool peut subir une oxydation non microsomiale en aldéhyde ou cétone, ainsi que différentes réactions de conjugaison.
Réaction réversible réalisée principalement par l'alcool déshydrogénase hépatique (LAD) en présence de NAD selon un transfert d'hydrure: II s'ensuit qu'un certain nombre d'alcools ne peuvent être oxydés: - les alcools tertiaires (pas d'H géminé à OH) - les alcools possédant de volumineuses chaines latérales (gène stérique) - le méthanol (trop petite chaîne latérale: pas d'affinité pour l'enzyme).
Ces biotransformations sont déterminantes dans la détoxication des alcools, elles peuvent également constituer une voie de bioactivation. Exemple: la bioactivation de l'éthylène glycol (utilisé comme antigel) est à l'origine d'une partie importante de sa toxicité:

L'acide oxalique forme des chélates avec le calcium (cf Acides) qui précipitent au niveau rénal entrainant des lésions irréversibles. Conséquences: lors d'intoxications par l'éthylène glycol on cherche à inhiber l'alcool DH en mettant par exemple les animaux sous coma éthylique!
Les glucurono et sulfoconjugaisons des alcools sont les plus fréquentes. Une méthylation sous l'action d'une méthyltransférase est également possible.
Son mécanisme est le suivant (SN2):

Le béta-glucuronide, ionisable, est bien plus hydrosoluble que l'alcool de départ, il est éliminé par l'urine ou la bile. Nota: les alcools résistants à l'oxydation sont très facilement glucuronoconjugués.
L'agent de sulfatation est le PAPS (3'phospho adénosine 5'phosphosulfate), la réaction peut se schématiser ainsi (SN2):

De très nombreux médicaments présentent des fonctions alcools qui contribuent
- à accroitre leur polarité.
- à faciliter leur dégradation et leur élimination par l'organisme.
- à permettre leur modification par des artifices galéniques (estérification, éthénfication).
Usage des alcools simples
Les alcools simples diffusent très bien au sein de l'organisme (caractère amphiphile) et présentent un tropisme particulier pour le foie et les tissus nerveux. Ils peuvent d'ailleurs augmenter la solubilisation de substances lipophiles dans le sang et faciliter ainsi leur passage dans le système nerveux central (l'éthanol et le sérum glucosé augmentent l'activité des barbituriques).
- Usage externe: Ethanol (C2HSOH): à 70%, antiseptique faible
Alcoolcétylique (C16H330H): excipient émulsifiant
- Usage interne: Propriétés dépressives du système nerveux central. Elles sont d'autant plus accentuées que l'alcool est ramifié et insaturé.
Ex.: Méthyl pentynol, sédatif doux qui aconduit à la synthèse du N-OBLIVON, tranquillisant.

- Excipients: glycérol, propylène glycol, polyoxyéthylène glycol (cf. galénique). Le glycol ou éthylène glycol, n'est pas utilisé car biotransformé en acide oxalique, toxique rénal (cf. toxicologie).
- Médicaments:
- Propylène glycol: anticétogène chez les ruminants car métabolisé en Ac. propionique et glucose.
- Sorbitol: cholagogue et facteur lipotrope.
- Inositol: facteur lipotrope.
- Mannitol: éliminé sans transformation par voie urinaire où il induit une diurèse osmotique. On utilise le soluté à 10 %.
Enfin de nombreux xénobiotiques ont un hydroxyl libre qui participe à l'action de la molécule et peut-être le site de réactions de biotransformations. Ces réactions, quand elles sont conduites chez les bactéries conduisent à une résistance acquise. Application: protection de l'alcool par acétylation (Ex. la triacétyl-oléandomycine est la forme triacétylée de l'oléandomycine) ou deshydroxylation (Ex. la tobramycine est la forme déshydroxylée de la kanamycine) ou encore remplacement de l'hydroxyle par un halogène (Ex. le florfénicol est fluoré alors que le chloramphénicol est hydroxylé).