
PHENOLS

L'introduction d'un hydroxyle sur un cycle aromatique augmente la possibilité de formation de liaisons intermoléculaires sur des composés qui étaient déja des liquides ou des solides. Les phénols sont donc des solides cristallins. Ils possédent en général une forte odeur caractéristique (de "gouache").
Leur insolubilité dans l'eau les différencie nettement des alcools.
Le phénol ("acide phénique") est faiblement hydrosoluble (une partie dans 20 à 20°C) mais très hygroscopique: on prépare le "phénol aqueux" en chauffant 9g de phénol avec lg d'eau, il cristallise vers 15°C et est utilisé pour préparer l'eau phéniquée officinale.
La réactivité des phénols tient de celle des alcools et de celle des dérivés benzéniques mais elle offre également de grandes particularités liées à la conjugaison des doublets électroniques de l'oxygène avec le cycle. Il s'ensuit que:
1) le clivage C-O est impossible,
2) les réactions de substitution électrophile sont facilitées et orientées en ortho et para,
3) les phénols sont plus acides que les alcools: pKa = 9-10. Seules les réactions entrainant le clivage O-H seront envisagées; elles peuvent être hétérolytiques ou homolytiques.
L'ion phénate est stabilisé par les formes mésomères suivantes:

Plus stable, il est moins basique que les ions alcoolates (les phénols sont donc plus acide que les alcools).
L'acidité des phénols est variable suivant les substituants par effet mésomère ou inductif:

Conséquences:
1) Pour former un ion alcoolate il faut traiter les alcools par du sodium métallique, pour un ion phénate un traitement par la soude aqueuse suffit.
2) Le cycle aromatique est capable de réagir comme réactif nucléophile (C-alkylation):

3) L'acidité des phénols explique au moins en partie leur caractère caustique, leur pouvoir germicide et leur toxicité. II a été montré que la liaison peptidique est une cible privilégiée des phénols du fait de la formation d'un complexe associant liaison hydrogène et transfert de charge conduisant à la dénaturation des protéines:

De la même manière que l'ion phénate, les radicaux libres de phénol sont stabilisés.
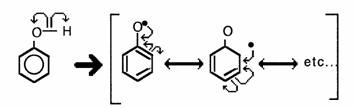
Les radicaux formés peuvent conduire par copulation à une structure de type biphényle qui en milieu basique est colorée

Applications
1) Les phénols sont capables d'éviter la propagation des réactions radicalaires en captant les radicaux libres et les détruisant lors de la copulation; ce sont des antioxydants.
Ex. : t.Butyl hydroxy toluène (BHT), t.Butyl hydroxyanisole (BHA), thymol, sels de l'acide gallique ...
2) Traités par le chlorure ferrique ils conduisent à une coloration caractéristique:
Phénol + Fe3+ --> radical phénol + Fe2+ + H+
La copulation des radicaux conduit à la formation de composés colorés: violet = phénol vert = catéchol rouge = pyrogallol ...
A titre d'exemple, cette réaction est utilisée par la pharmacopée pour la caractérisation de l'acide salicylique.
Essentiellement P450 dépendantes elles peuvent correspondre à la formation de quinones ou de quinone-imines cytotoxiques.
Ex: bioactivation du paracétamol

Le métabolite N-hydroxylé se déshydrate spontanément en N-acétylparaquinone-imine, hépatotoxique.
Rappelons que c'est la formation de composé radicalaire par la myéloperoxydase qui explique une partie de la toxicité du benzène et son interdiction en tant que solvant (cf. Hydrocarbures)
Essentiellement des glucuronoconjugaisons et des
sulfoconjugaisons.
Le chat, déficient en glucuronyltransférase des phénols, est
sensible à tous les phénols:
- salicylés dont l'aspirine, en particulier -
phénicolés, éliminés aprèés hydroxylation du cycle et glucuronoconjugaison
-
paracétamol: la toxicité de ce composé est particulière dans cette espèce:
anémie hémolythique...
Il n'est en revanche pas déficitaire en glucoronyltransférases des alcools, acides, amines
Les phénols simples (c'est-à-dire sans autre fonction chimique) sont utilisés comme antiseptiques et éventuellement insecticides externes.
- monophénols
- eau phénolée (1 à 2%) :antiseptique, calmant et antipungineux, mais risque de nécrose cutanée.
- crésylol (mélange des créosols, o, m et p).
- thymol
- béta-naphtol et benzonaphtol (benzoate de (3-naphtol): exception = antiseptique intestinal.
- polyphénols
- pyrocathécol, pyrogallol, gaïacol, hexylrésorcinol.
- goudrons: produits phénoliques bruts obtenus par pyrogénation de la houille ou du bois (goudron de cade, créosotre de hêtre .... ).
La toxicité des phénols peut se manifester localement, principalement à l'occasion de leur utilisation comme antiseptiques, ou de façon générale après ingestion, inhalation, ou contact cutané prolongé.
- toxicité locale: dermatose puis gangrène.
- toxicité générale: les phénols induisent des troubles nerveux (convulsions puis coma) et des oedèmes pulmonaires.