HYDROCARBURES
Les hydrocarbures regroupent un grand nombre de composés toxiques, polluants de l'environnement ou à l'origine d'intoxications professionnelles. Les substances médicamenteuses sont rarement de simples hydrocarbures, cependant un certain nombre d'entre eux sont utilisés comme excipients. Ils forment en outre le "squelette" de toute substance organique.
1.1- Structure et nomenclature
1.2- Propriétés physiques et chimiques
2.1- Structure et nomenclature
2.2- Propriétés physiques et chimiques
4.1- Structure et nomenclature
4.2- Propriétés physiques et chimiques
On reconnaît six séries homologues, c'est-à-dire six "séries de composés ayant une structure uniforme, pouvant être représentés par une formule générale et montrant une graduation linéaire des propriétés physiques" (en particulier point de fusion, point d'ébullition et solubilité). L'évolution des propriétés à l'intérieur d'une même série peut être quantifiée à l'aide d'indices qui sont utilisés pour prévoir à partir de la structure d'un composé sa réactivité biologique. Cette méthode peut être généralisée aux substances fonctionnalisées (alcools, halogénures ... etc. : travaux de HANSCH)
|
|
aliphatiques |
alicycliques |
|
saturés |
ALCANES |
CYCLANES |
|
|
ALCENES |
CYCLENES |
|
insaturés |
ALCYNES |
|
|
|
HYDROCARBURES AROMATIQUES |
|
|
ALCANES (CnH2n+2) ALKYLIDENES |
groupements ALKYLES
|
|
méthane CH4 méthylidène = méthylène CH2< |
méthyle - CH3 (Me)
|
|
éthane CH3-CH3 éthylidène CH3-CH< |
éthyle - CH2 - CH3 (Et)
|
|
propane C3H8 |
propyle - CH2 - CH2 - CH3 (Pr) isopropyle - CH (CH3)2 (iPr) |
|
butane C4Hl0 |
butyle - CH2 - CH2 - CH2 - CH3 (Bu) |
|
|
isobutyle - CH2 - CH (CH3)2 (i Bu) |
|
|
tertiobutyle - C (CH3)3 (t-Bu) |
|
pentane C5H12 |
pentyle = amyle - CH2 - CH2 - CH2 - CH2 - CH3 |
|
|
Isopentyle - CH (C2H5)2 |
|
|
isoamyle - CH2-CH2-CH (CH3)2 |
|
|
néopentyle - CH2 - C (CH3)3 |
|
octane CH3-(CH2)6-CH3 |
octyle - CH2 -(CH2)6- CH3 |
Nota :
- groupements alkylidènes, exemples
CH2C12 chlorure de méthylène
CH2 (OH) - CH2 (OH) éthylène glycol
- positionnement par rapport à un C fonctionnalisé
![]()
Nous nous contenterons de quelques éléments de représentation.
- Cyclohexane (représentation en perspective):

côtés 2 à 2 parallèles
- Ha: hydrogènes axiaux (verticaux, vers le haut si sommet monte et inversement)
- He: hydrogènes équatoriaux (parallèles aux côtés situés en a-b )
- Décaline (représentation plane)



Les liaisons C-C
et C-H n'étant pas polarisées, les alcanes sont des composés apolaires et
inertes.
Apolaires: ils sont insolubles dans l'eau et solubles dans les
solvants organiques non polaires.
Inertes: ceci est rappelé par le terme de
"paraffine", du latin "parum affinis " (quia peu d'affinité), utilisé en anglais
pour désigner tous les alcanes ("paraffinic hydrocarbons") et en français un mélange
d'hydrocarbures saturés extrait du pétrole, utilisé comme excipient pour
pommades, ....
La préparation des diverses fractions de pétrole utilise cette
inertie: les alcanes sont distillés après un traitement à l'acide sulfurique
concentré et chaud qui détruit tout autre composé.
|
Hydrocarbon |
Formula |
b.p. (°C) |
m.p. (°C) |
|
Méthane |
CH4 |
-162 |
-188 |
|
Ethane |
CH3-CH3 |
-87 |
-172 |
|
Propane |
CH3-CH2-CH3 |
-42 |
-187 |
|
n-Butane |
CH3-(CH2)2-CH3 |
-0,5 |
-135 |
|
n-Pentane |
CH3-(CH2)3-CH3 |
+36 |
-130 |
|
n-Hexane |
CH3-(CH2)4-CH3 |
69 |
-94 |
|
n-Heptane |
CH3-(CH2)5-CH3 |
98,4 |
90 |
|
n-Octane |
CH3-(CH2)6-CH3 |
125,6 |
-57 |
|
n-Nonane |
CH3-(CH2)7-CH3 |
149,5 |
-51 |
|
n-Decane |
CH3-(CH2)8-CH3 |
173 |
-32 |
|
n-Undecane |
CH3-(CH2)9-CH3 |
195 |
-26,5 |
|
n-Dodecane |
CH3-(CH2)10-CH3 |
21 5 |
-1 2 |
|
n-Tridecane |
CH3-(CH2)11-CH3 |
234 |
-6,2 |
|
n-Tetradecane |
CH3-(CH2)12-CH3 |
252 |
+5 |
|
n-Pentadecane |
CH3-(CH2)13-CH3 |
270 |
1 0 |
|
n-Hexadecane |
CH3-(CH2)14-CH3 |
287 |
1 8 |
|
n-Heptadecane |
CH3-(CH2)15-CH3 |
303 |
22,5 |
|
n-Octadecane |
CH3-(CH2)16-CH3 |
317 |
28 |
|
n-Nonadecane |
CH3-(CH2)17-CH3 |
330 |
32 |
|
n-Eicosane |
CH3-(CH2)18-CH3 |
208/15mn |
37 |
|
n-Heneicosane |
CH3-(CH2)19-CH3 |
219/15 |
40,4 |
|
n-Docosane |
CH3-(CH2)20-CH3 |
230/15 |
44,4 |
|
n-Tricosane |
CH3-(CH2)21-CH3 |
240/15 |
47,7 |
|
n-Tetracosane |
CH3-(CH2)22-CH3 |
250/15 |
51,1 |
Les alcanes volatils sont bien absorbés par voie pulmonaire et diffusent ensuite jusqu'au système nerveux central grâce à leur grande lipophilie: ce sont des toxiques nerveux, le cyclopropane était anciennement utilisé comme anesthésique général.
Les biotransformations sont
limitées: hydroxylations microsomiales plus ou moins suivies de glucurono- ou sulfo-conjugaisons.
Les alcanes liquides à
longue chaîne ne sont pas absorbés par voie orale
(l'huile de paraffine permet ainsi l'évacuation du contenu digestif et limite
l'absorption des toxiques).
|
Alcènes |
Groupements alcènyles |
|
Ethylène CH2 = CH2 |
(éthylène) vinyle - CH = CH2 |
|
Propène CH3 - CH = CH2 |
allyle(propène-2-yle) - CH2 - CH = CH2 |
|
|
propényle (isoallyle) - CH = CH - CH3 |
|
|
isopropényle - C (CH3) = CH2 |
|
Butène-1 CH2 = CH - CH2 - CH3 |
butényle - CH = CH - CH2 - CH3 |
|
Butène-2 CH3 - CH = CH - CH3 |
crotyle (crotonyle) - CH2 - CH = CH - CH3 |
|
Isobutène (méthyl-2propène) CH2 = C (CH3)2 |
isobutényle - CH = C (CH3)2 |
|
Diènes |
|
|
Cumulés (allènes) : exemple, l'allène CH2 = C = CH2 |
|
|
Conjugués : exemple, l'isopropène CH2 = CH (CH3) - C = CH2 |
|
|
(l'isopropène est à l'origine des terpènes eux-mêmes très voisins des composés stéroïdiques.) |
|
Les propriétés physiques et
chimiques des alcènes sont très voisines de celles des alcanes; les 3 premiers
membres de la série sont gazeux, ceux de C5 à C 15 liquides et les plus lourds
solides à la température ambiante.
L'introduction d'une insaturation
dans une molécule accroît sa lipophilie.
D'un point de vue chimique, les alcènes sont en revanche des composés très réactifs.
Les réactions d'addition sont
principalement ioniques; elles concernent surtout les halogènes (X2), les
hydracides halogénés (HX), les acides hypohalogéneux
(HOX), les acides organiques (HOOC-R), l'eau (hydratation sulfurique), et
les alcènes eux mêmes (polymérisation: polyéthylène, isoprène, terpènes).
Elles
sont alors catalysées par H+ .
Parfois radicalaires,
elles concernent par exemple: Br2, H-SH, Cl-C Cl3, Br-C Cl3 ... et sont catalysées par les peracides.
Ex: décoloration de l'eau de Brome (Brome à saturation dans l'eau); signe la
présence d'une insaturation.

De la même façon le brome d'iode (I+ Br-) conduit au produit d'addition:

L'iodure en excès est converti en iode après adjonction d'iodure de potassium: IK+IBr ->I2+KBr. L'iode peut-être dosé par une solution titrée de thiosulfate de sodium.
Application: détermination de l'indice d'iode qui caractérise le degré d'insaturation des huiles utilisées en pharmacie galénique ou des matières grasses de l'alimentation.
- Le permanganate de potassium (KMn04) à chaud entraîne une scission avec oxydation des produits formés

une telle oxydation est une étape
de la purification de nombreuses substances non oxydables. Ex.: cocaïne.
- Ozonolyse: scission avec conservation des produits
formés.
- Peracides: formation d'époxydes

Cette réaction a été utilisée en 1979 par GARNER pour reproduire expérimentalement l'activation de l'AFB1 (mycotoxine présente dans les aliments des animaux et de l'homme) hépatocancérogène puissant, en son dérivé époxyde qui est reconnu depuis lors comme le métabolite responsable de la toxicité. In vivo l'époxydation de l'AFB1 est principalement réalisée par les monooxygénases cytochrome P450 dépendantes.
De nombreux composés insaturés tels le benzène, le bromobenzène et les hydrocarbures polycycliques aromatiques doivent leur pouvoir nécrogène ou cancérogène à une activation de ce type (cf réactivité biologique).
- Peroxydation et oxydation allylique : la peroxydation des alcènes par l'oxygène de l'air se réalise facilement en présence de lumière et d'impuretés (ions métalliques). La présence d'un H en a autorise un réarrangement aboutissant à l'oxydation allylique.

Une telle oxydation est également à l'origine du rancissement des matières grasses.
Les réactions de réduction des alcènes sont principalement catalytiques (LiAlH4, HCl et Zinc à chaud), elles offrent peu d'intérêt en pharmacie et ne sont pas décrites in vivo.
Les alcènes sont moins utilisés que les alcanes en tant qu'excipient en raison de leur mauvaise stabilité (grande réactivité chimique); on préfère de même les huiles saturées aux huiles insaturées (d'où l'intérêt de la détermination de l'indice d'iode des huiles).
Rappelons que l'introduction d'une Maturation dans une molécule accroît sa lipophilie et modifie donc son devenir dans l'organisme (cf barbituriques).
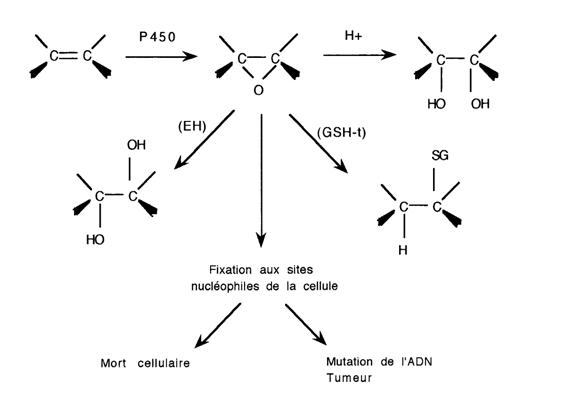
L'époxydation microsomiale représente la principale des biotransformations des alcènes. L'époxyde ainsi formé est très instable (forte tension de cycle), il se décompose en alcool (la réaction peut être facilitée par une enzyme: l'époxyde hydrolase [EH] cytosolique), est conjugué au glutathion (spontanément ou par catalyse par les glulathion transférases [GSH-t] cytosoliques ou microsomiales) ou se fixe de façon covalante aux sites nucléophiles de la cellule (azote de la lysine, thiols des protéines, azote en position 7 de la guanine).
acétylène (éthyne): HCCH éthynyle: -CCH
propyne: HCC-CH3 propynyle: -CC-CH3
Semblable à celle des alcènes, en outre les alcynes vrais sont des acides.
De nombreux microorganismes sécrètent des composés polyacétyléniques.
La mycomycine : HCC - CC - CH = C = CH - (CH = CH)2 - CH2 - COOH est un antibiotique antifongique.


Les hydrocarbures aromatiques sont extraits du goudron de houille et sont séparés en fonction de let point d'ébullition: jusqu'à 100°C pour le benzène, le toluène et les xylènes; de 180 à 210°C pour les phénols; vers 230°C pour le naphtalène et au delà de 300°C pour l'anthracène et le phénanthrène. Ces dernier composés sont solides à la température ordinaire, les premiers sont des solvants très employés ma: dangereux car toxiques: on recommande en particulier aujourd'hui de proscrire le benzène pour 1 remplacer par le toluène, moins dangereux.
La principale réaction des composés aromatiques est la substitution électrophile qui ne sera pas décrit ici. Il est bon toutefois de rappeler les principaux agents de substitution.
|
SUBSTITUTIONS |
AGENTS |
REACTIFS |
||
|
Nitration |
N02+, |
ion nitronium |
HN03 concentré |
|
|
|
|
|
H2S04 concentré |
|
|
Nitrosation |
NO+, |
ion nitrosonium |
HCI |
|
|
|
|
|
NaNO2 (nitrite de sodium) |
|
|
Sulfonation |
S03H+, |
ion sulfonium |
H2S04 fumant = oléum |
|
|
|
|
|
=H2S04+S03 |
|
|
Halogénation |
CI+, |
ion chloronium |
CI 2 |
|
|
|
|
|
AIC13 (catalyseur) |
|
|
Acylation |
R-CO+, |
ion acylium |
RCO-CI + AICl3 (catalyseur) |
|
|
|
|
|
ou (RCO)20 + AICl3(-) |
|
|
Alkylation |
R+, |
ion alkylium |
R-CI |
|
|
|
|
|
AICl3 (catalyseur) |
|
Les hydrocarbures aromatiques sont susceptibles de réaliser également un certain nombre de réaction radicalaires Exemple l:

Exemple 2 :

Conséquence: on ne peut pas stériliser les solutions aqueuses contenant des substances aromatiques par les radiations ionisantes.
La réactivité biologique des
hydrocarbures aromatiques est souvent secondaire à leur biotransformation par
différentes mono-oxygénases, principalement P450
dépendantes.
A titre d'exemple le Benzopyrène subit
une activation par le Cyt P450 en 9,10-époxyde
qui est ensuite hydrolysé par l'époxyde hydrolase. Une seconde époxydation en position 11-12 conduit à un
intermédiaire très réactif qui est fixé par les bases nucléophiles des acides
nucléiques:

C'est après une biotransformation hépatique suivie d'une bioactivation dans les cellules de la moelle osseuse que le benzène exerce son action toxique:

Il faut également noter que les hydrocarbures aromatiques polycycliques sont de puissants inducteurs des biotransformations hépatiques:
