
AMINES ET DERIVES
1.1- Structure et nomenclature
2- Sels d'ammoniums quaternaires
3.1- Structure et nomenclature
Les amines sont des dérivés organiques de substitution de NH3 caractérisés par leurs propriétés basiques et nucléophiles. Seront envisagés: amines, sels d'ammonium quaternaires et dérivés d'oxydation des amines.



Les amines I et
Il forment des liaisons hydrogènes intermoléculaires mais elles
ne sont pas aussi fortes que celles des alcools (elles sont plus
volatiles qu'eux, mais moins que les hydrocarbures correspondants).
Les amines tertiares ne forment pas de liaisons hydrogènes intermoléculaires
et sont très volatiles.
Les amines aromatiques ne sont pas
volatiles.
Les amines de faible poids moléculaire sont solubles
dans l'eau et les alcools (liaisons hydrogènes avec le solvant);
les plus lourdes ainsi que les amines aromatiques ne le sont pas.
Toutes les amines sont solubles dans une grande variété de
solvants organiques.
Enfin, tous ces composés présentent une
odeur désagréable plus ou moins forte "de poisson".
La paire d'électrons libres portée par l'azote confère aux amines des propriétés basiques et nucléophiles qui dominent la chimie de ces composés.
a- Mise en évidence:
Pratiquement toutes les amines sont solubles dans les acides dilués

On notera les deux dénominations possibles des halogénures formées: chlorure d'alkylammonium et chlorhydrate d'alkylamine, bromure et bromhydrate. Celles qui emploient le suffixe hydrate sont généralement préférées. A l'opposé les autres sels ne possèdent qu'une seule dénomination: sulfate,
phosphate, benzoate . d'alkylammonium.
b- Mesure
La basicité est variable, elle est mesurée par le pKb ou mieux le pKa de l'acide conjugué correspondant: pKb(R-NH2) + pKa(R-NH3+) = 14 La base est d'autant plus forte que le pKb est petit soit que pKa est élevé:

Les amines aliphatiques sont plus basiques que l'ammoniac: l'effet donneur augmente la disponibilité du doublet.

Les aromatiques le sont beaucoup moins: l'effet mésomère réduit la disponibilité du doublet. Mais dans ce cas, la présence de substituants sur le cycle a une grande importance:

Enfin les hétérocycles azotés présentent la même basicité que les amines simples lorsqu'ils sont non aromatiques, mais une nette différence lorsqu'ils sont aromatiques:

c- Applications
- Amines tampons:
Le trométanol (DCI) ou TRAM (tri-Hydroxyméthyl Amino Méthane) Trisamidol ND) est utilisé en pharmacie pour combattre l'acidose et comme alcalinisant urinaire.

Il est également connu des biochimistes sous le nom de Tampon-TRIS. La triéthanolamine a les mêmes usages.
- Formation de sels (cf aussi Acides) :
* Sels minéraux: chlorhydrates, bromhydrates, sulfates (HS04 ), carbonates (HC03-).
Ils présentent de façon générale une meilleure hydrosolubilité que la forme non salifiée et permettent de préparer des formes pharmaceutiques injectables.
Les solutions aqueuses de ces sels sont toujours très acides (pH = 1 à 3 pour les Tétracyclines).

Exception: Les alcaloïdes sont au contraire précipités sous forme de sels insolubles car non dissociés. Ce sont souvent des sels mixtes; ces réactions sont utilisés pour l'identification des alcaloïdes:

* Sels organiques:
Beaucoup moins hydrosolubles, utilisés pour des raisons variables:
Ex. l: La formation d'un sel entre l'acide Pamoïque et le Pyrantel permet de masquer le goût amer de ce dernier (Pamoate de Pyrantel = anthelminthique nématocide).
Ex.2: Sel de soude et de Pénicilline G ou sel de Procaïne et de Pénicilline G: seul l'antibiotique à un effet thérapeutique, la procaïne permet d'obtenir un effet retard. (cf Acides)
Ex.3: Stéarate, lactobionate, glucoheptonate ... d'érythromycine utilisés pour masquer l'amertume et stabiliser l'antibiotique lors de son administration orale.
La nucléophilie des amines varie dans le même sens que leur basicité.
Les principales réactions sont schématisées dans le tableau ci-dessous, qui introduit également la nomenclature des fonctions chimiques qui peuvent être synthétisées.

Les applications sont nombreuses: synthèse chimique, chimie analytique, incompatibilités des médicaments aminés, toxicologie...
a- Synthèses:
- des ammoniums quaternaires:

- des sulfonamides:
en pharmacie ce terme est réservé à une importante famille d'antibactériens de synthèse dérivés de la sulfanilamide.

- des carbamates anticholinesterasiques:

b- Chimie analytique:
La formation de bases de Schiff colorées permet de caractériser les amines primaires aromatiques.

c- Incompatibilités des médicaments aminés:
Nombreuses, elles sont toujours à redouter, en particulier pour les amines primaires aromatiques (sulfonamides, ampicilline, procaïne...). A la suite d'une stérilisation par la chaleur le sérum glucosé, par exemple, contient toujours une petite quantité d'aldéhydes et d'acides organiques provenant de la dégradation du glucose. Les premiers dans une réaction catalysée par les seconds se condensent avec les médicaments de structure amine primaire aromatique pour former des substances insolubles ou inactives.
Les amines tertiaires peuvent être également partiellement inactivées par "carbonatation" par le gaz carbonique de l'air: les bicarbonates d'ammonium formés, sels non dissociés, sont insolubles dans l'eau et précipitent, ce qui représente une forte diminution de leur biodisponibilité.
Les réactions d'alkylation peuvent également intervenir; l'ensemble fait des médicaments aminés le groupe qui présente le plus d'incompatibilités d'origine chimique.
d- Moutardes azotées et signification toxicologique des alkylations:
Les moutardes azotées sont des agents anticancéreux qui présentent toutes une structure de chloréthylamines. Elles s'activent par alkylation intramoléculaire:

Les cellules cancéreuses sont plus sensibles à ces substances que les cellules normales car elles se multiplient plus vite.
Cette réaction est un exemple particulièrement démonstratif de la réactivité des bases puriques ou pyrimidiques de l'ADN et de TARN: à l'image des amines simples, les atomes d'azote nucléophiles de ces biomolécules représentent autant de sites d'alkylation mis enjeu aussi bien sous l'action des moutardes azotées que par les substances carcinogènes ou mutagènes (cf. chap.l). De la même manière, en raison de leurs nombreuses fonctions amines libres (lysine, arginine, histidine), les protéines peuvent être également alkylées ou adylées ce qui est utilisé pour expliquer le pouvoir nécrogëne (bromobenzène) ou l'allergénicité (pénicillines, lévamisoles ...) de certains médicaments et toxiques.
La nitrosation est une réaction complexe entre les amines et l'acide nitreux naissant qui présente un double intérêt analytique et toxicologique.
Elle met en jeu le pouvoir nucléophile des amines et les propriétés particulières de la liaison N-N formée. L'acide nitreux instable est préparé dans le milieu réactionnel:

Le réactif nitrosant est l'ion nitrosonium formé par protonation puis déshydratation de l'acide nitreux:

Le produit de la réaction de nitrosation dépend de la nature de l'amine:
- Amines II et III: Nitrosamines, importance toxicologique.

Les amines III réagissent de la même manière après dégradation en amine II sous l'action de l'acide nitreux.
Les nitrosamines sont des composés liquides, jaunes, neutres et cancérogènes. La stabilité du groupement N-nitroso formé ( >N-N=O) provient de la double substitution de l'azote (:# des amines primaires).
Dans l'organisme, l'oxydation des draines latérales rompt cette stabilité et conduit après une série de réactions à l'alkylation des acides nucléiques (cf Toxicologie).

- Amines I aromatiques: Diazotation, importance analytique.
Les amines primaires aromatiques forment, en présence d'acide nitreux, des sels diazoïques selon une réaction quantitative (c'est à dire qui peut être utilisée pour le titrage). Cette réaction comprend 3 étapes

Le diazonium est stabilisé par résonance avec le cycle aromatique

Application en chimie analytique: utilisé par la Pharmacopée pour caractériser et doser les amines primaires aromatiques:
- Les diazoniums formés sont solubles dans l'eau et incolores; ils sont révélés par copulation avec un composé aromatique en milieu alcalin: on obtient ainsi un composé azoïque coloré.
- Dans un dosage, la détermination du point d'équivalence utilise la mise en évidence de l'excès de nitrite par oxydation des iodures en iode qui bleuit l'amidon (papier ioduroamidoné) ou par potentiométrie.

N.B.: dans les mêmes conditions les amines primaires aliphatiques sont désaminées car le diazonium n'est pas stabilisé, un dégagement gazeux signe la présence d'une amine 1 aliphatique:

Toutes les amines sont facilement oxydables, le mode d'oxydation dépend de la structure de l'amine et de la nature de l'agent oxydant:
a) oxygène:
Catalysée par la lumière, les impuretés métalliques et la chaleur, l'oxydation par l'air impose la conservation en flacons bruns, parfois sous azote, en présence de chélateurs et d'antioxydants et éventuellement au frais. Ce sont des réactions radicalaires.
- amines aromatiques: très sensibles, formation de composés azoïques colorés par oxydation portant sur l'azote. La procaïne, les sulfonamides .... sont ainsi dégradés.

- amines aliphatiques: oxydation portant sur le carbone

b) oxydants oxygénés:
(KMn04, peracides...) souvent complexe. Schématiquement on obtient un N-oxyde qui se réarrange et est oxydé à son tour d'une manière variable suivant la classe de l'amine et sa structure: obtention de Noxydes, d'hydroxylamines, d'oximes, de nitroso et de nitroalcanes.
La N-oxydation métabolique des amines suit un schéma similaire (cf infra).
Les alcaloïdes sont oxydés en leurs dérivés N-oxydes qui régénèrent par réduction le composé parent d'où leur noms: génalcaloïdes. La réduction ne peut se faire dans l'organisme: les génalcaloïdes tout en conservant les mêmes propriétés que les alcaloïdes sont beaucoup moins toxiques (génésérine - ésêrine; génatropine - atropine).
c) oxydation par chloration:
Formation de chloramines, composés instables qui s'hydrolysent en présence d'eau avec formation d'acide hypochloreux d'où leurs propriétés antiseptiques.

En phase I il s'agit de N-oxydation, de N-désalkylation ou de désamination. Lorsque les produits formés s'y prêtent la phase II est constituée principalement de glucurono et sulfo conjugaisons ; ou plus rarement d'acétylation. Les implications toxicologiques de ces transformations doivent être connues: une fonction amine doit toujours être suspectée de pouvoir initier des voies de bioactivation. Ces réactions sont toujours en compétition entre elles et avec celles pouvant porter sur les autres parties de la molécule.
Réalisées par des flavoprotéines microsomiales hépatiques en présence de NADPH et d'oxygène moléculaire, les N-oxydations suivent un schéma réactionnel similaire à celui des oxydations par les peracides.
Les amines tertiaires sont oxydées en N-oxydes stables et plus hydrosolubles que le produit de départ détoxication.
Les N-oxydes des amines primaires et secondaires peuvent subir des réarrangements qui expliquent la formation d'oximes, d'hydroxylamine et de composés nitrosés ou nitrés souvent toxiques directement ou après conjugaison: bioactivation (Ex: acétylaminofluorène).

Le réarrangement des hydroxylamines en oximes est possible en présence d'un H en alpha

Elles sont réalisées par les cytochrome P450 suivant un mécanisme semblable à celui de la Odésalkylation des éthers: hydroxylation du C en a suivie du départ du substituant sous forme d'aldéhyde ou de cétone et libération de l'amine sous forme réduite.
On notera le préfixe "nor" qui signe la structure déméthylée du composé (adrénaline - noradrénaline ; morphine - normorphine, ....).
D'une manière générale elle est, comme la désalkylation, la conséquence de l'oxydation du C en a ou provient de l'hydrolyse d'une oxime intermédiaire:

La monoamine oxydase (MAO), FAD dépendante, située dans les terminaisons nerveuses, désamine les amines biogènes (adrénaline, noradrénaline, dopamine et 5 hydroxytryptamine) et quelques composés très voisins (amines I, II et III). Les polyamines oxydases, FAD dépendantes, oxydent les amines II.
La N-acétylation, conjugaison par l'acétyl CoA, est une réaction de phase II qui peut conduire à un composé moins hydrosoluble que le produit de départ; le cas des sulfonamides est particulièrement démonstratif des implications toxicologiques du phénomène:

Les différences interspécifiques sont importantes, un polymorphisme génétique est connu.
La glucurono et la sulfoconjugaison des amines s'effectue après leur hydroxylation en hydroxylamines. Elle fourni des composés instables qui sont souvent l'objet de réarrangements intramoléculaires conduisant à la formation de métabolites toxiques.
Ex: biotransformations du 2-AAF

La fonction amine est partagée par un très grand nombre de substances médicamenteuses d'origine végétale ou de synthèse. Ceci explique la fréquence des dénominations communes qui présentent les suffixes "amine" (Ex: mépyramine,...) ou "ine" (Ex: codéine, cocaïne, morphine,...).
Les alcaloïdes sont des substances d'origine végétale de structure hétérocyclique azotée (ce qui leur confère un caractère alcalin). Ils sont caractérisés par une activité biologique intense, rapide et fugace. Plus de 5.000 alcaloïdes sont aujourd'hui connus. Leur basicité est mise à profit pour:
- leur extraction à partir des plantes (hydrosolubilité en milieu acide, solubilité dans les solvants organiques basiques).
- la préparation de sels hydrosolubles (chlorhydrate de morphine, de cocaïne, sulfate d'atropine,...) Elle rend compte d'une bonne absorption intestinale: la strychnine est un poison violent.
Leur structure complexe n'autorise pas une synthèse facile et divers composés de remplacement, plus simples, ont été créés. De telles manipulations, fondées sur l'étude des relations structure-activité, permettent en outre de moduler l'activité de la substance mère.
Exemples: analgésiques centraux (stupéfiants)

Nombre d'entre elles trouvent leur activité dans une analogie structurale avec une amine endogène. La fonction amine possède dans ce cas une réelle signification biologique, elle est incluse dans la partie pharmacophore (responsable de l'activité) de la substance médicamenteuse.
a) dérivés de la phényléthylamine:
Apparentés aux catécholamines sympathomimétiques

b) antihistaminiques:

Structuralement proches, les sels d'ammoniums quaternaires présentent très peu de caractères communs avec les amines en raison de l'utilisation du doublet de l'azote pour une quatrième liaison, conduisant à un cation stable et constamment ionisé.
Ils se présentent sous forme de sels neutres, formant des solides cristallins souvent hygroscopiques. Ils sont solubles dans l'eau mais insolubles dans les solvants organiques et les lipides: - ils ne sont pas absorbés par voie orale - après injection parentérale ils n'ont qu'une action périphérique et extra-cellulaire. Les ammoniums quaternaires à longue draine sont en outre des détergents. Leur réaction principale est la dégradation d'HOFMANN qui présente peu d'intérêt en pharmacie (dégradation par chauffage conduisant à une amine tertiaire et un alcène).
Par analogie structurale avec l'acétylcholine, diverses substances naturelles ou de synthèse présentent des propriétés cholinomimétiques ou cholinolytiques:

Les agents de surface cationiques sont des sels d'ammoniums quaternaires. Réservés à l'usage externe, ce sont des bactériostatiques intéressants qui présentent lors d'ingestion accidentelle une toxicité importante en relation avec leur structure: propriétés curarisantes.

Les dipyridiliums sont des herbicides de contact sélectifs, actifs sur les parties aériennes des végétaux, ils perturbent, par leur réduction, la réaction de HILL (réduction du NADP+). Ingérés ces produits vont exercer une action caustique sur les muqueuses digestives (gastroentérite hémorragique). Leur absorption entraine la survenue d'oedèmes pulmonaires et d'insuffisance rénale.

Ils sont nommés comme des produits de substitution des hydrocarbures correspondants:

- Les Nitroalcanes sont des liquides volatils et incolores.
- Les Nitrobenzènes des solides cristallins ou des liquides non volatils, jaunes, oranges ou rouges. Insolubles dans l'eau ils sont solubles dans les solvants organiques. Ce sont eux-mêmes de très bons solvants (polymères, résines...) mais toxiques par absorption ou inhalation.
Les composés nitrés sont caractérisés par le groupement nitro (-N02) qui est un hybride de résonance entre les deux formes mésomères suivantes:

Leurs propriétés chimiques sont marquées avant tout par le caractère électroattracteur du groupement Nitro ; les conséquences en série aromatique et en série aliphatique sont différentes.
Le groupement nitré est conjugué au cycle aromatique, il s'en suit:
- une coloration de ces dérivés,
- une désactivation du cycle et orientation en méta lors de substitution électrophile,
- un caractère acide, ex. paranitrotoluène:

L'anion formé est généralement plus coloré que le produit de départ: la réaction peut être utilisée pour caractériser les dérivés nitroaromatiques. Ex: caractérisation officinale de la Procaïne après oxydation:

Les nitroalcanes possédant un H en a sont des acides:

Ceci rend compte de leur caractère nucléophile en milieu basique:

Enfin, les dérivés nitrés sont thermiquement instables, (le TriNitroToluène est même un explosif) et donnent, après réduction, les réactions de caractérisation des amines.
Elles sont intéressantes à plusieurs titres (cf schéma réactionnel):
- il s'agit de réductions réalisées par des réductases multiples, ubiquitaires et mal connues qui semblent peu spécifiques: elles reconnaissent comme substrat aussi bien les dérivés nitrés que tous les autres dérivés d'oxydation des amines.
- ce sont des réactions radicalaires sensibles à l'oxygène (02 est réduit en anion superoxyde toxique: 02-), libérant des intermédiaires monoélectroniques réactifs: processus de bioactivation qui explique le caractère toxophore (= responsable de la toxicité) du groupement N02 et des autres dérivés d'oxydation des amines.
- par ce mécanisme elles peuvent expliquer les propriétés antibactériennes ou antiparasitaires des médicaments nitrés (cf 3.5.): certains mutants de E.coli résistants au nitrofural ont perdu une ou plusieurs réductases (Mac Calla 1975).
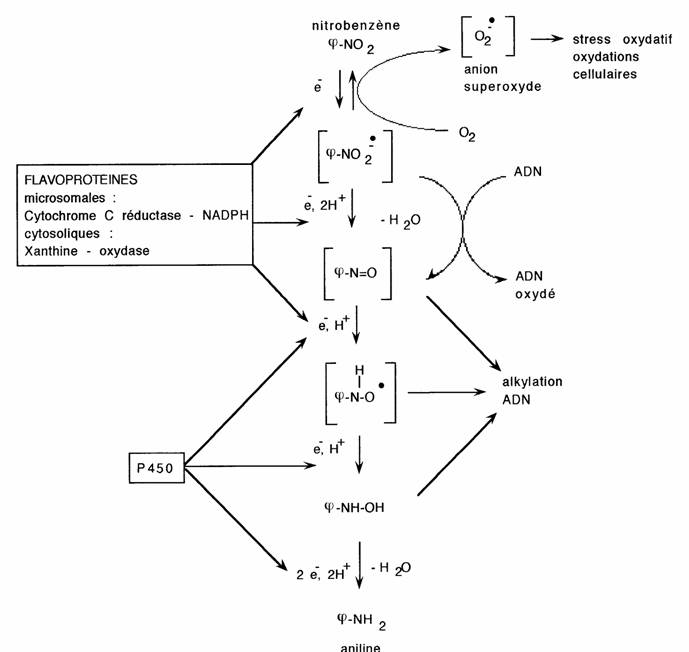
La toxicité des composés nitrés peut cependant être plus ou moins sélective; c'est le cas des principaux médicaments nitrés antibactériens ou antiparasitaires:

Toutefois, tous ces composés sont aujourd'hui interdits chez les animaux de rente par crainte d'effets toxiques de leur résidus.
Notons que, dans le cas du chloramphénicol, le groupement nitro n'est pas indispensable. II peut être remplacé par un groupement méthyl-sulfone (cp - N02 -> cp - S02 - CH3) qui exerce le même effet attracteur sur le cycle aromatique. Ce groupement est ainsi retrouvé sur le Thiamphénicol et le Florphénicol, ce dernier étant autorisé chez certains animaux de rente.
Dans le cas des Nitrofuranes, le groupement nitro semble en revanche indispensable, l'activité de ces composés pouvant s'expliquer par une alkylation des constituants bactériens après action de nitro-réductases, selon un schéma métabolique voisin de celui présenté pour le nitro-benzène.
Enfin de nombreux antiparasitaires appartenant à d'autres séries présentent un groupement nitro: Nitroscanate, Niclosamide, Niclofolan, .... Nombre d'entre eux exercent leur effet en perturbant les transferts d'électrons chez les helminthes.
Le groupement nitré est un toxophore reconnu. Le nitrobenzène manifeste toute la toxicité de ces composés qui signe une altération de la phosphorylation oxydative et se caractérise par l'atteinte des tissus possédant un métabolisme énergétique important: moelle osseuse (agranulocytose, hémorragies) et système nerveux central (convulsions, "folie" ...).
Les herbicides du groupe des nitrophénols, sont des herbicides de contact plus ou moins sélectifs, ainsi que des débrousaillants. Ils agissent en perturbant le transfert d'électrons chez les végétaux et sont découpleurs de la phosphorylation oxydative chez les animaux. Leur toxicité se manifeste par une forte hyperthermie liée à la dissipation en chaleur de l'énergie non utilisée pour la phosphorylation de l'ATP.

- Hydroxylamines: R-NH-OH
Dérivés de substitution de l'hydroxylamine (NH20H), ce sont des composés basiques et nucléophiles.
- Dérivés nitrosés: R-N=O
Composés instables qui s'oxydent facilement en dérivés nitrés. Ceux qui présentent un H en a se tautomérisent en oximes.
- Oximes : R, R' - C = N -OH
Composés instables en série aliphatique (hydrolyse facile en cétones + ammoniaque), plus stables en série aromatique (conjugaison), ils présentent alors une nucléophilie importante. La pralidoxime (Contrathion ND) est utilisé comme réactivateur des cholinestérases:

- Nitrites : R-O-N= O
Ce sont des isomères des dérivés nitrés. Ils présentent une structure d'ester facilement hydrolysable.

Ce sont des vasodilatateurs coronariens: Ex: nitrite d'isoamyle (CH3)2-CH-CH2-CH2-O-N=O