
ACIDES CARBOXYLIQUES ET DERIVES

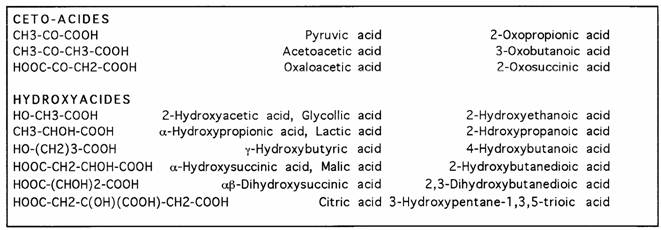
L'introduction d'un groupement acide carboxylique permet la formation d enombreuses liaisons intermoléculaires de faible énergie:
En conséquence, seuls les premiers acides monocarboxyliques sont des liquides solubles dans l'eau, tous les autres acides carboxyliques simples sont des solides cristallins peu ou pas hydrosolubles. Les acides polyfonctionnels présentent des solubilités variables :
- acides alcools: plus hydrosolubles que les acides simples,
- acides insaturés: moins hydrosolubles, ...etc.
La dénomination d'acides gras est réservée aux acides monocarboxyliques à chaine linéaire, comprenant plus de 8 atomes de carbone: ce sont des solides cireux utilisés en pharmacie comme lubrifiants pour comprimés.
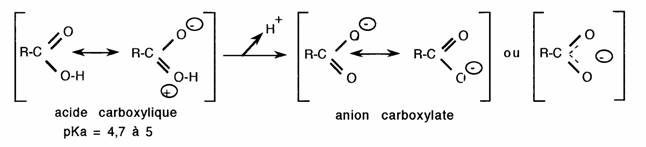
Elle tient compte simultanément de la polarité de la liaison O-H et de la stabilité de l'anion carboxylate, on notera l'importance de la mésomérie:
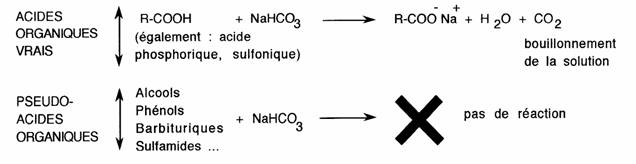
Les acides carboxyliques décomposent le bicarbonate de sodium ce qui les oppose aux pseudo acides organiques:
Les effets inductifs et mésomères modifient la labilité du proton carboxylique ou la stabilité de l'anion carboxylate: ces variations sont mesurées par le pKa.
Les différentes classes d'acides se différencient nettement, l'effet des substituants est parfois très important:

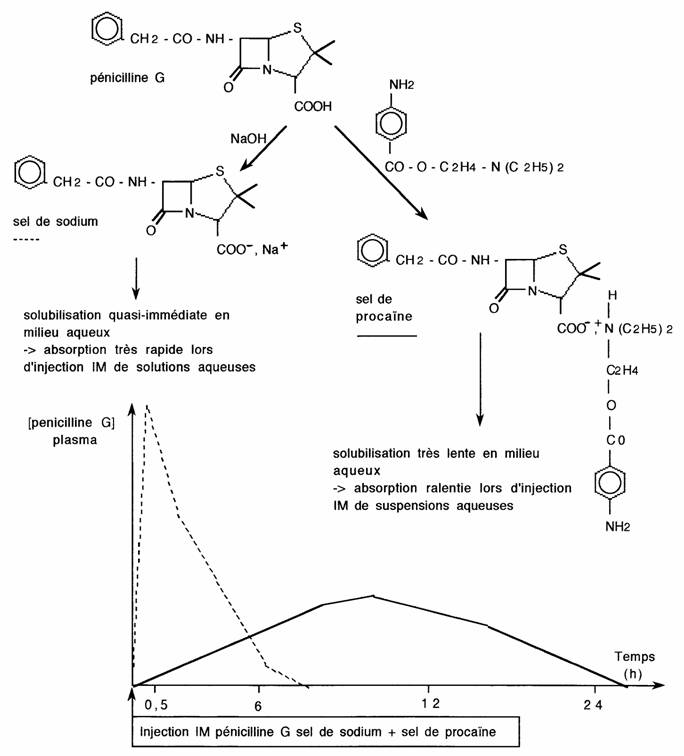
L'obtention de sels minéraux hydrosolubles autorise l'extraction et la purification des substances acides à partir de milieux complexes (préparation de la Pénicilline G ....). Sous cette forme les principes actifs présentent une grande souplesse d'utilisation (aliment, eau de boisson, I V...). Mais en relation avec le caractère d'acide faible, ces sels sont sujets à l'hydrolyse et leurs solutions sont alcalines:
R - COONa + H20 --------> R - COOH + Na+ + OH- pH = 10-12
Les sels organiques restent souvent peu à pas solubles dans l'eau, leur biodisponibilité est différente
Exemple: commercialisation de la Pénicilline G sous différents sels:
Remarque: comme les esters, la formation de sels peut stabiliser certains composés organiques et permettre leur utilisation par VO.
Exemple: érythromycine base dégradée chez les monogastriques lors de son administration par VO. Ses sels (stéarates, lactobionates, galactopyranosyl-gluconate, glucoheptonate) sont plus stables et administrables par VO.
- Les sels d'acides gras sont amphiphiles (savons alcalins): chaine hydrocarbonée lipophile, groupement carboxylate hydrophile. Employés comme détergents et émulsifiants ils présentent de nombreuses incompatibilités (précipitation) qui signent l'instabilité de l'anion carboxylate:
en milieu acide: hydrolyse,
avec les détergents cationiques: déplacement des sels,
en présence de Ca, Mg (dureté de l'eau).
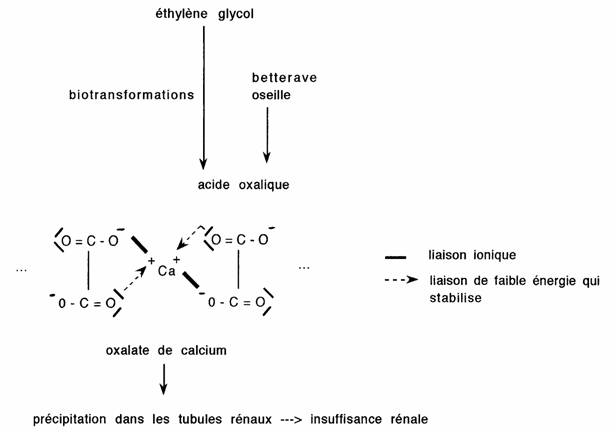
- Les diacides forment des chélates insolubles avec les cations divalents:
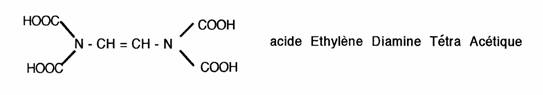
Application: commercialisation de l'EDTA = chélateur des métaux lourds. Utilisé lors d'intoxications, il permet l'excrétion urinaire de ces composés.
Ce sont des substances obtenues par substitution sur le groupement carbonyle des acides carboxyliques.
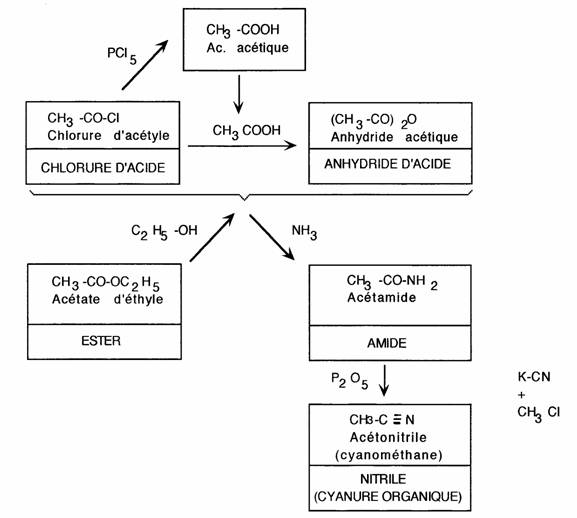
La préparation des dérivés d'acides est schématisée dans le tableau suivant: on notera l'importance des anhydrides et des chlorures d'acides pour la synthèse. La nomenclature est dérivée de celle des acides.
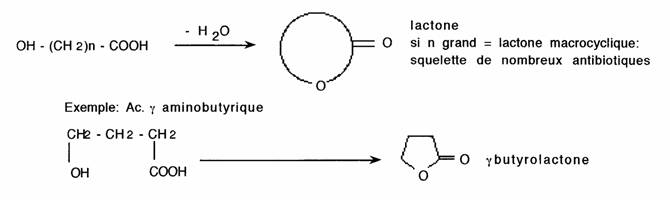
Les lactones sont des esters cycliques d'acides alcools.
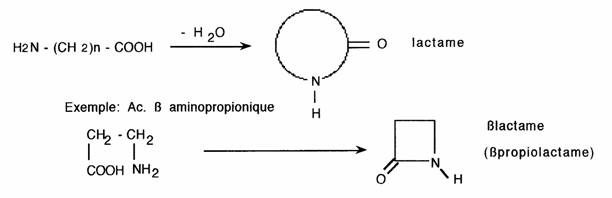
Les lactames sont des amides cycliques d'acides aminés.
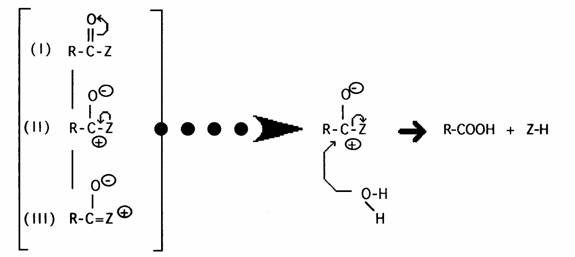
L'hydrolyse représente la principale réaction des dérivés d'acides qui possèdent en outre toutes les propriétés des composés parents à l'exception de leur acidité. Le schéma réactionnel permet de comparer la réactivité relative des différentes classes de dérivés Seule la forme mésomère II réagit
Plus Z est donneur moins le dérivé est réactif:
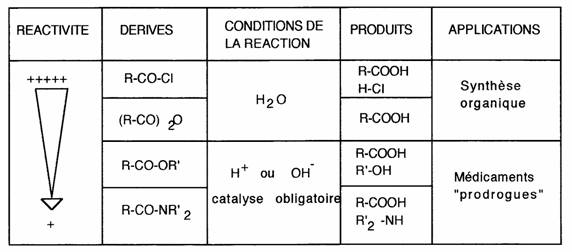
Esters et amides sont donc suffisamment stables pour être utilisés comme médicaments. Dans l'organisme leur hydrolyse est:
- spontanée: estomac (pH acide), si composés hydrosolubles
- enzymatique: estérases (sériques, hépatiques, rénales...) et amidases (hépatiques seulement).
Conséquences de l'hydrolyse:
- Inactivation du principe actif
Exemple: anesthésiques locaux de synthèse:
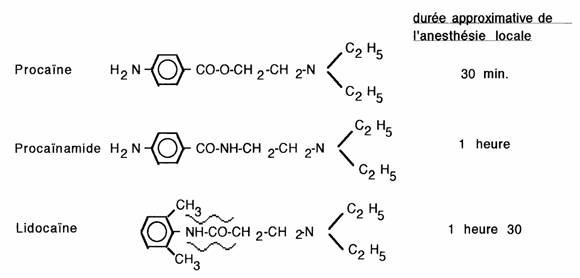
Le cas de la lidocaïne montre l'importance de l'effet stérique sur la labilité de la liaison
- Bioactivation: libération du principe actif à partir d'une prodogue.
Exemples: antibiotiques et antibactériens (cf Alcools):
- Pénéthacilline = ester de penicilline G et de diéthyléthanol amine (lipophile => diffusion intracellulaire).
- Chloramphénicol: commercialisé sous forme d'hémisuccinate (hydrosoluble => utilisable en IV), palmitate (non amer par VO).
- Erythromycine commercialisée sous forme d'adipate (hydrosoluble et stable par VO), de propionate (non amer et stable par VO) ...
Tous ces composés sont des "prodrogues", c'est-à-dire que l'ester est lui même inactif, il faut qu'il y ait hydrolyse pour avoir une libération du principe actif.
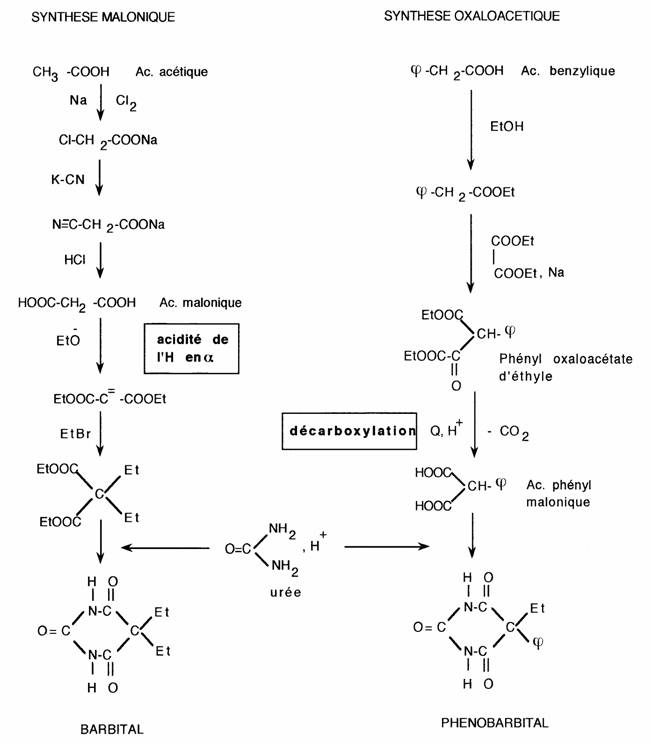
Elles sont dominées par:
- l'acidité de l'hydrogène en alpha
- la possibilité de décarboxylation
Les acides carboxyliques sont essentiellement glucurono et
sulfo-conjugués.
Leurs dérivés peuvent être hydrolysés par des estérases
ou amidases (suivant des conditions qui respectent l'ordre de réactivité cité
plus haut) et être secondairement conjugués.
= destruction des structures cellulaires.
- Acides purs: acide acétique, acide trichloracétique: usage externe, exérèse chimique de tissus mortifiés.
- Acides dilués ou sels (Na, K): acide tartrique, acide citrique, acide benzoïque et leurs sels: usage interne, effet secrétoire, purgatifs (mucus), diurétiques.
- Acidifiants digestifs: acide acétique à 6 % (vinaigre officinal); acide lactique: acides dilués par voie orale, eupeptiques (monogastriques) antifermentaires, traitement de l'intoxication par l'urée (polygastriques).
- Sels alcalinisants: polyacides-alcools (meilleure efficacité et hydrosolubilité): lactate de sodium à 1,9 % (isotonique), citrate de sodium: par voie IV, lutte contre l'acidose, alcalinisants urinaires.
- Antiseptiques et antifongiques: usage externe, rendent le milieu dysgénésique acides propionique et lactique et leurs sels (antiseptiques)
acides propionique et undécylénique (antifongiques).
Pour les diacides ou les acides alcools, avec les cathions di ou trivalents. - Ac oxalique -> oxalates de calcium et insuffisance rénale
- EDTA -> lutte contre les intoxications par certains métaux lourds (Plomb: Pb", Cuivre: Cu++...) - Tétracyclines, quinolones: antibactériens, caractère chélateur participe sans doute au mécanisme d'action. Est à l'origine d'une diminution de la biodisponibilité lors d'administration par voie orale avec du lait, certains pansements gastriques (Al+++).
- De nombreux sels minéraux d'acides carboxyliques sont utilisés pour les propriétés du cation. Exemple: gluconate de calcium: l'acide gluconique sert à solubiliser le sel de calcium.
- Le groupement carboxyle n'est pas un pharmacophore mais il est fréquemment rencontré dans certaines familles de médicaments: antiinflammatoires non stéroïdiens en particulier.