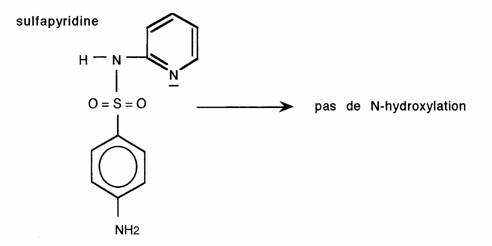
3- Réactivité chimique chimiques
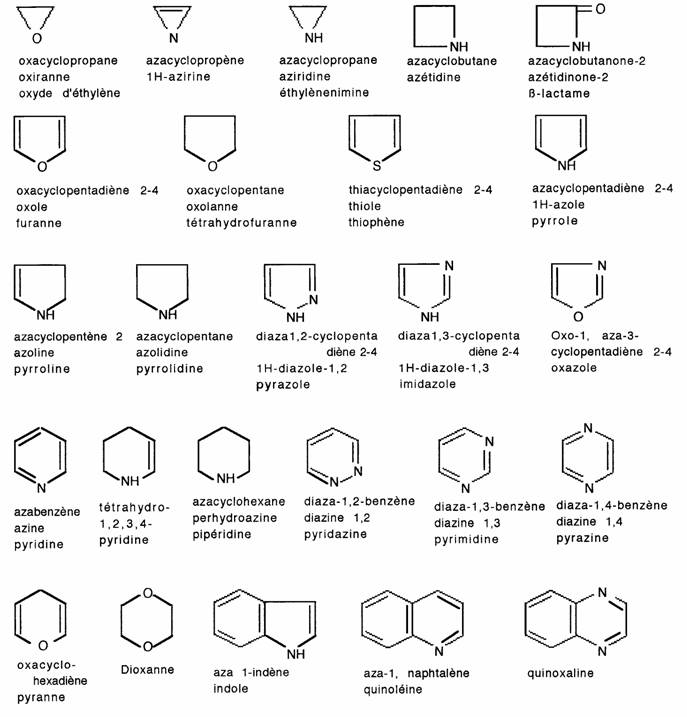
3.1- Hétérocycles non aromatiques
4.1- Hétérocycles non aromatiques
Les composés hétérocycliques, possèdent une structure cyclique contenant un ou plusieurs hétéroatomes : O, S, N, P, As, Si, B, ....
- par la nature de l'hétéroatome: les hétérocycles oxygénés, soufrés et azotés sont les plus importants.
- par le nombre de chaînons : les hétérocycles à 5 et 6 chaînons sont les plus stables et les plus fréquents.
- par le degrè d'insaturation (analogie avec les composés carbocycliques): hétérocycles saturés, hétérocycles éthyléniques (partiellement saturés), hétérocycles aromatiques (insaturés).
On reprend pour les composés hétérocycliques le nom de l'hydrocarbure cyclique correspondant
précédé du ou des préfixes indicatifs des hétéroatomes, classés dans l'ordre ci-dessous:
- oxygénée (valence lI): oxa - phosphore (valence I1I): phospha
- soufre (valence II): thia - silicium (valence IV): sila
- azote (valence lIl): aza
Elle utilise le ou les préfixes déjà vus (avec élision du "a" si nécessaire) pour indiquer la nature des hétéroatomes plus une terminaison qui comporte:
- une racine correspondand au nombre de chaînons du cycle
- un suffixe lié au degré d'insaturation et au fait que l'hétérocycle est azoté ou non.
Terminaison |
|||||||
Nombre |
cycle azoté |
cycle non azoté |
|||||
de |
Racines |
insaturation |
insaturation |
||||
chaînons |
maximale |
partielle |
nulle |
maximale |
partielle |
nulle |
|
3 |
ir |
- ir ine |
- ir idine |
- ir ène |
- ir arme |
||
4 |
et |
- èt e |
- ét ine |
- ét idine |
- èt e |
- ét ène |
- ét aune |
5 |
ol |
- ol e |
- ol ine |
- ol idine |
- ol e |
- ol ène |
- ol aune |
6 |
aucune |
- ine |
* |
* * |
- inne |
* |
- anne |
7 |
ep |
- ép ine |
* |
* * |
- ép inne |
* |
- ép anne |
8 |
oc |
- oc ine |
* |
* * |
- oc inne |
* |
- oc anne |
9 |
on |
- on ine |
* |
* * |
- on inne |
* |
- on anne |
10 |
ec |
- éc ine |
* |
* * |
- éc inne |
* |
- éc anne |
* les préfixes dih-tétrahydro etc... sont accolés au nom de l'hétérocycle insaturé correspondant
** même chose avec le préfixe perhydro.
Consacrée par l'usage, se rajoute aux précédentes !

Malgré leur analogie structurale avec les composés carbocycliques les hétérocycles ne sont pas nécessairement isostères de leurs analogues carbonés (à titre d'exemple la pyridine est un liquide miscible à l'eau et présentant un caractère basique).
Les hétérocycles saturés et éthyléniques sont dans une large mesure semblables aux composés aliphatiques correspondants
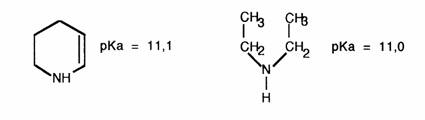
La pipéridine est une amine II qui présente la même basicité que la diéthyl amine.
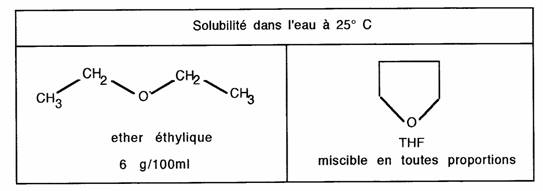
Le tétrahydrofurane et le dioxanne sont des éthers qui possèdent le même pouvoir solvant (solvatation) et les mêmes inconvénients que l'éther éthylique (péroxydation -> explosion).
La cyclisation introduit cependant quelques petites différences
- La conformation cyclisée expose l'hétéroatome aux liaisons hydrogènes d'où une meilleure solubilité dans l'eau.
- L'hétéroatome active le cycle: les hétérocycles (ex. oxiranne) sont moins stables que leurs analogues carbonés (ex. cyclopropane). La taille est néanmoins très importante: les cycles à 5 et 6 chaînons sont les plus stables.
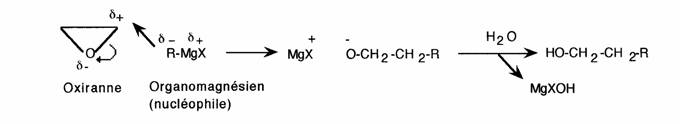
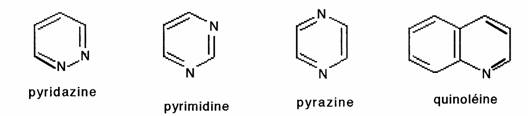
Analogues du benzène, ils sont différents par leurs propriétés physiques (solubilité dans l'eau) et chimiques; il est commode de distinguer deux types d'hétérocycles aromatiques: pyndine et pyrrole:
- Pyridine Le sextet électronique comprend un électron ir de chaque sommet (5C et 1N); l'azote conserve son doublet non-liant; les formes mésomères montrent que les sommets 2, 4 et 6 sont positivés:

Tous les hétérocycles azotés aromatiques à 6 chaînons sont ainsi positivés:
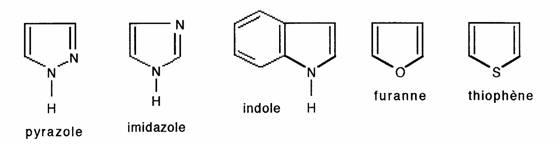
- Pyrrole Le sextet électronique englobe le doublet de l'azote pour l'associer aux 4 électrons ar des 4 C ; les formes mésomères montrent que les sommets 2 et 5 sont négativés:

Tous les hétérocycles aromatiques à 5 chaînons sont ainsi négativés:
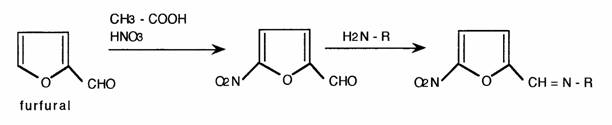
- Substitution électrophile: Les hétérocycles positivés sont peu réactifs et les substitutions sont orientées sur les sommets qui ne sont pas désactivés: C3 et C5 pour la pyridine. Les hétérocycles négativés sont très réactifs ; les substitutions sont orientées en 2 et 5 pour le pyrrole, le furane, le thiophène. Exemple: Synthèse des nitrofurannes: l'acide acétique suffit à la nitration du furanne alors que la nitration du benzène réclame l'utilisation du mélange sulfonitnque:
- Substitution nucléophile:
II s'agit d'une particularité qui singularise les cycles positivés:
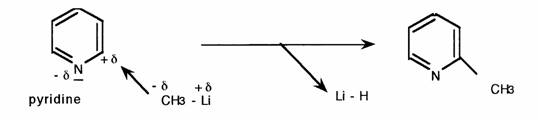
De la même manière les H en beta sont labiles:
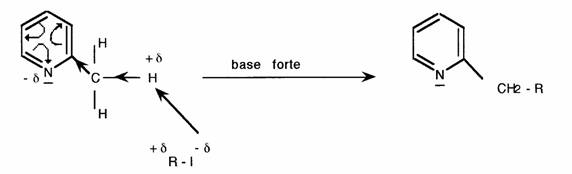
- Basicité (hétérocycles azotés):
- Hétérocycles négativés: le doublet de l'azote est englobé dans le sextet électronique = il n'est pas disponible:

- Hétérocycles positivés: le doublet de l'azote est libre. En raison du caractère électro-attracteur du sextet électronique la pyridine est toutefois moins basique que son dérivé saturé la pipéridine:

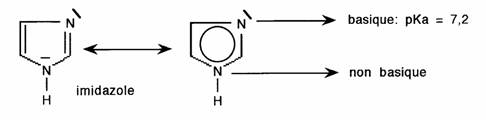
- Cas particulier: cycle diazotés. L'imidazole présente deux atomes d'azote: l'un basique (dit "tertiaire" : il est identique à celui de la pyridine), l'autre non basique (dit "secondaire" : il est identique à celui du pyrrole):
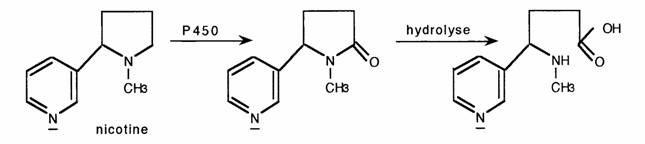
En phase I les hétérocycles subissent un métabolisme oxydatif qui différencie nettement les composés suivant leur classe.
Les hétérocycles non aromatiques sont oxydés sur les C ce qui peut conduire à la rupture du cycle. Ex: Nicotine:
Les hétérocycles aromatiques sont plus résistants à l'oxydation, ils sont donc plus stables. Ils peuvent toutefois subir des hydroxylations:
- Les noyaux négativés subissent préférentiellement une C-oxydation qui peut conduire à la rupture du cycle:
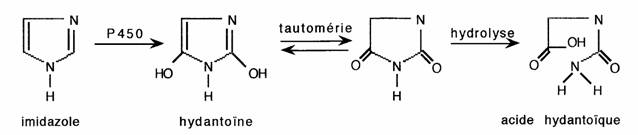
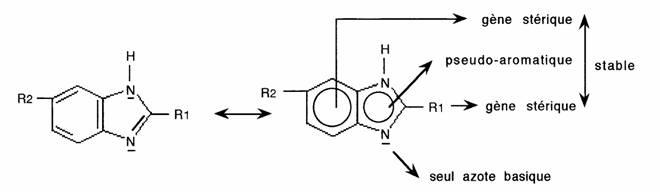
Application: la substitution des sommets 2 et 5 des benzimidazoles interdit l'oxydation de l'hétérocycle qui est ainsi stabilisé in vivo:
- Les noyaux positivés subissent préférentiellement une oxydation portant sur l'hétéroatome sans rupture de cycle:
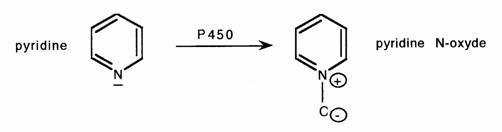
La réaction peut être empêchée par gène stérique (substituant volumineux sur le carbone en alpha):