
Les dérivés halogénés sont utilisés comme anesthésiques, insecticides et pesticides. Certains antibactériens sont également halogénés. Ce sont en outre des solvants ou des intermédiaires de synthèse très employés au laboratoire. Enfin, un grand nombre de composés sont des polluants de notre environnement.
3.1- Réactivité des dérivés halogénés
4.2- Déshalogénation oxydative
4.3- Déshalogénation réductive
4.4- Réactions de substitutions (conjugaisons)
5.2- Composés organiques halogénés
Dérivés du METHANE |
Dérivés de l'ETHANE |
|
| chlorure de méthyle | CH3C l | chlorure d'éthyle CH3 - CH2C l |
| chlorure de méthylène | CH2C12 | dichloro-1, 2 éthane Cl-CH2-CH2-Cl |
| chloroforme | CHC13 | Hexachloroéthane C13C-CC13 |
| tétrachlorure de carbone | CC14 | chloréthylène CH2=CH-CI |
| bromure de méthyle | CH3B r | = chlorure de vinyle |
| bromoforme | CHBr3 | dichloro-1, 2 éthylène CI-CH=CH-CI |
| iodoforme | CH13 | Trichloréthylène Cl-CH=C(Cl)2 |
| fréon 11 ( PE = 24°C) | CFC13 | Tétrachloroétylène (Cl)2 C=C(Cl)2 |
| fréon 12 ( PE = -30°C) | CF2C12 | |
| fréon 22 | CF2HC1 | fréon 112 F (Cl)2 C-C (Cl)2 F |
| = difluorotétrachloroéthane | ||
| Dérivés du | PROPANE | fréon 1 14 ( PE =3,5°C) CI (F)2 C-C (F)2 C l |
| dichloro-1, 3 propane | Cl-CH2-CH2-CH2-Cl | = tétrafluorodichloroéthane |
| dichloro-1, 3 propène | Cl-CH=CH-CH2-Cl | |
| dibromo-1, 2 propane | CH3-CHBr-CH2Br | Halothane (F)3 C-C H (Br) (Cl) |
| = Trifluoromonochloromonobromoéthane | ||
| Dérivés du BUTANE | ||
| Méthoxyflurane CH30-C(F)2-CH(Cl)2 | ||
| dichloro-2, 2 butane | CH3-C(CI)2-CH2-CH3 | = méthoxydifluorodichloroéthane |
| monochloro-2 butène | CH2=C(CI)2-CH2-CH | Enflurane CH(F)20-C(F)2-CH(F)(Cl) |
| = difluorométhoxy-1,difluoro-1,2,chloro-2 éthane | ||
Nota : Nomenclature des fréons: chiffre des centaines = nombre d'atomes de C moins 1, chiffre des dizaines = nombre d'atomes d'H plus 1, chiffre des unités = nombre d'atomes de F. La dénomination commune n'est pas toujours la dénomination systématique recommandée par HUPAC: par exemple le chlorure de méthylène (ancienne dénomination) devrait être nommé dichlorométhane.
Hexachlorocyclohexane (HCH)

Ex: isomère 13: tous les H sont axiaux

L'introduction d'un halogène n'augmente que modérément la polarité de la molécule (en comparaison avec les alcanes). A l'exception des premiers membres de la série qui sont des gaz, les composés halogénés aliphatiques sont des liquides mobiles, volatils, ininflammables et inertes. Pour un halogène donné, la volatilité et la densité décroissent lorsque la masse moléculaire s'accroît (c'est-à-dire allongement de la chaîne ou augmentation du nombre d'halogènes).
Les composés halogénés alicycliques et aromatiques sont des liquides jaunâtres de consistance huileuse ou des solides pâteux jaunâtres à brunâtres.
La grande volatilité des premiers composés rend compte de leur utilisation comme anesthésique local par réfrigération (ex. Fréon 114 ou cryofluorane) ou comme gaz propulseurs pour les générateurs d'aérosols (fluoro-alcanes de la série des Fréons, des Foranes ....etc). Les dérivés fluorés sont préférés en raison de la plus grande stabilité de la liaison C-F: meilleure inertie chimique.
Les dérivés halogénés sont aussi des solvants largement utilisés dans l'industrie pharmaceutique en raison de leur caractère ininflammable et malgré leur forte toxicité.
Malgré la grande polarisation des liaisons C-X, les dérivés halogénés ne sont pas miscibles à l'eau. Ce sont des composés lipophiles qui traversent aisément les téguments (insecticides par contact). La formation de liaisons hydrogènes entre halogène et hydrogène en milieu hydrophobe peut rendre compte de la bioaccumulation de certains dérivés halogénés dans les matières grasses. Les composés aromatiques constituent des polluants très stables de notre environnement. Une température de 900°C est imposée aux industriels pour la destruction des dioxines lors des combustions de déchets. Des réactions de photodéshalogénation sont possibles, mais lentes.
La liaison C-X est polarisée, le carbone devient sensible à l'attaque par des nucléophiles.
Elle dépend avant tout de l'halogène considéré. On reconnait des réactions hétérolytiques et homolytiques
L'halogène absorbe les électrons de la liaison C-X, par opposition aux réactions radicalaires. Dans un ordre de stabilité croissante on trouve R-I < R-Br < R-Cl < R-F, en raison de la polansabilité des liaisons qui est fonction:
- de la longueur des liaisons: C-I > C-Br > C-Cl > C-F
- de la stabilité de X- (F- est très peu stable car le fluor est le seul halogène ne possédant pas d'orbitale d; ceci rend compte de la stabilité particulière des fluoroalcanes).
On distingue deux types de réaction:
- Substitution Nucléophile Il s'agit d'une réaction d'ordre 2 (SNI passe par l'intermédiaire d'un carbocation).
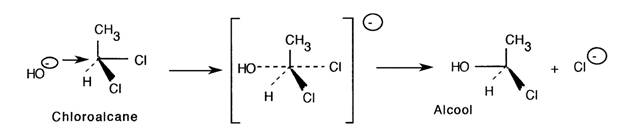
- Elimination Nucléophile Il s'agit d'une réaction d'ordre 2 (ENI passe par l'intermédiaire d'un carbocation).

L'ordre de stabilité de la liaison C-X est similaire, mais l'on doit reconnaitre deux types de réactions radicalaires

Exemple: formation d'un organomagnésien

Ces réactions ont un intérêt analytique
Exemple: identification des chlorures
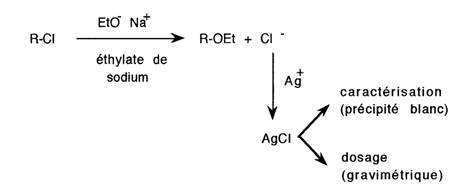
Les applications de la substitution nucléophile sont résumées dans le tableau suivant. Il faut y ajouter celles très importantes des organomagnésiens.

La sensibilité à l'oxydation des dérivés halogénés doit être connue car elle conduit toujours à des produits toxiques (acides halogénés corrosifs). Ils subissent une oxydation radicalaire conduisant par l'intermédiaire d'un hydroperoxyde à divers produits de réarrangement.
Exemple: oxydation du chloroforme en phosgène, hépatotoxique

Application: emploi d'anti-oxydants dans les anesthésiques volatifs halogénés
Ces réactions sont très importantes car un grand nombre d'entre-elles conduisent à une bioactivation de ces composés à l'origine d eleur toxicité
La déshydrochloration représente une voie très répandue de métabolisation réalisée dans le foie selon un mécanisme semblable à la trans-élimination E2: le y-hexachlorocyclohexane (y-HCH ou Lindane) en représente un bon exemple, le 13-HCH un bon contre exemple. L'introduction d'une ou plusieurs insaturations permet l'hydroxylation du composé et sa glucuronoconjugaison. Ces biotransformations permettent une élimination relativement rapide du y-HCH alors que le 13HCH persiste plusieurs mois dans l'organisme.

Application: purification stéréoisomérique du y-HCH et utilisation comme antiparasitaire externe (encore autorisé chez les animaux de compagnie) et pesticide (interdiction récente).
La déshalogénation oxydative représente également une voie très répandue de métabolisation réalisée dans le foie. Elle diffère de la précédente par la nature des métabolites formés. Exemple du chloroforme: formation de phosgène, puissant alkylant des macromolécules

La déshalogénation réductive en présence de NADPH représente une autre vole de bioactivation des composés halogénés. Elle constitue un des rares exemples de réduction de phase I par les cytochromes P45U. La métabolisation de l'halothane (anesthésique gazeux) montre bien, à ce propos, la stabilité des liaisons C-F. Les radicaux libres libérés sont responsables de la toxicité hépatique de ce composé (un tel mécanisme de toxicogenèse s'observe également pour CH C13, C C14 et d'autres halogénoalcanes).

Elles sont rares dans l'organisme en raison de la stabilité intrinsèque de la plupart des composés halogénés (pesticides en particulier). L'agent de substitution est le glutathion (mercaptoconjugaison), les réactions sont catalysées par des glutathion transférases (GSH-t), leurs conséquences sont variables:
- Ces réactions peuvent correspondre à des bioactivations.
Exemple: la conjugaison du dibromoéthane peut générer un sulfonium, alkylant et mutagène
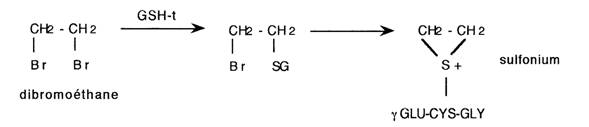
- Ces réactions peuvent également conduire à un transport à distance de métabolites toxiques.
Exemple: le trichloroéthylène conjugué au GSH est excrété par les reins où il subit le métabolisme des GSH-conjugués. Le cystéinyl-conjugué est N-acétylé et éliminé ou bioactivé en thiolate.

- Remarque:
La possibilité de biotransformation dépend fortement du positionnement des halogènes par rapport au carbone (cf. HCH) et de leur accessibilité pour les enzymes de biotransfomation. Ainsi, le DDT résiste à ces systèmes enzymatiques, d'ou la rétention de ce composé dans l'organisme et sa bioaccumulation.

On peut différencier les propriétés des organohalogénés vrais: ne contiennent que C, H et X, des composés organiques appartenant à des groupes chimiques et thérapeutiques variés, dans lesquels on peut rencontrer des atomes d'halogènes.
Les organohalogénés vrais se subdivisent en différents groupes thérapeutiques en fonction
- de la nature de l'halogène

- de la structure du composé, pour les dérivés chlorés en particulier.
- dérivés aliphatiques
| simples asymétriques | symétriques |
| anesthésiques généraux: | antiparasitaires: |
| - chloroforme CHCl3 | - tétrachlorure de carbone CCl4 |
| - trichloréthylène Cl2 C = CHCI | - tétrachloroéthylène C12 C = C Cl2 |
| - hexachloroéthane Cl3 C - C Cl3 | |
| mixtes dérivés du méthane: | dérivés de l'éthane: |
| (Cl et F) - fréons (industrie) | - halothane, méthoxyflurane, enflurane |
| (anesthésiques volatils) |
- dérivés cycliques et aromatiques
Insecticides: antiparasitaires externes, pesticides

Polluants: inducteurs de certains systèmes enzymatiques, ± cancérogènes

Le rôle de l'halogène est alors très variable.
- l'halogène modifie la solubilité de la molécule et donc son devenir dans l'organisme:
Exemple: les benzimidazoles sont des anthelminthiques inhibant la polymérisation de la tubuline. Laplupart des composés sont nématocides ± cestocides. Certains sont de spectre très large, étant également douvicides. Le triclabendazole, trichloré, subit une importante excrétion biliaire à l'origine de son activité douvicide exclusive. La quasi-totalité des anthelminthiques douvicides sont halogénés et subissent une forte excrétion biliaire.
- l'halogène modifie l'action pharmacologique de la molécule:
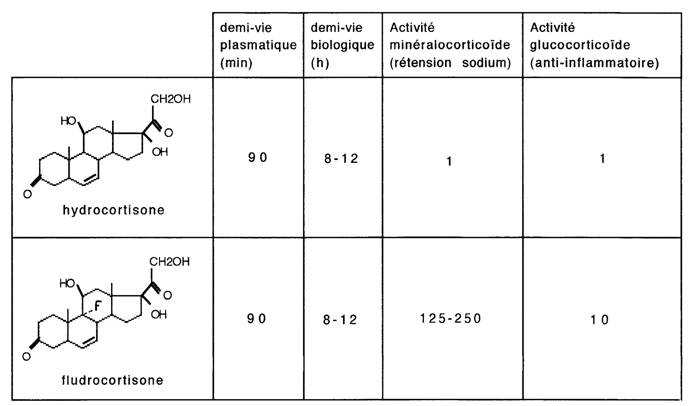
Exemple: Le fluor ne modifie pas la demi-vie biologique de la fludrocortisone mais lui confère une forte activité minéralocorticoïde
- l'halogène restaure l'action pharmacologique de la molécule:
Exemple: Le fluorphénicol résiste aux chloramphénicol acétyl-transférases bactériennes responsables d'une partie des résistances acquises à cet antibiotique
