Métabolisme de l’halothane et ses conséquences
Barraquand C., Deloncle R., Etienne C.L., Sallé G.
L’anesthésie générale chirurgicale par inhalation fut la première méthode moderne de narcose (= sommeil artificiel obtenu par administration d’un médicament, en particulier au cours d’une anesthésie générale), avec le protoxyde d’azote (Davy), puis l’éther, dont la première utilisation date de 1805 (Warren). A l’heure actuelle, nous leur préférons d’autres molécules, comme l’halothane (ou fluothane).
L’Halothane est un dérivé halogéné, de la famille des fréons qui ont été développés à partir des années 60 afin de remplacer les anesthésiques volatiles et dangereux, tels que le chloroforme. Ce dernier a été à l’origine d’accidents par sensibilisation du myocarde à l’adrénaline. Ces anesthésiques sont appréciés en raison de la sécurité qu’ils offrent, puisque les doses administrées sont très bien contrôlées. Ils réclament cependant un matériel particulier.
Nous introduirons tout d’abord la structure de cette molécule, ainsi que les propriétés physico-chimiques qui en découlent, et son mode d’utilisation en tant qu’anesthésique. Par la suite son métabolisme global, c’est-à-dire métabolisme au sens strict et élimination, seront envisagés. Enfin, sa toxicité engendrée sera décrite.
I – Présentation de la molécule
1. Structure
Formule chimique semi-développée :
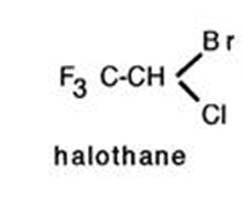
|
Numéro cas |
Formule moléculaire brute |
Noms français |
Noms anglais |
|
151-67-7 |
C2HBrCIF3 (PM = 197,39) |
- Halothane (DCF)
- Bromo-2chloro-2trifluoro-1,1,1 éthane
- Trifluoro-1,1,1 bromo-2 chloro-2 éthane |
- Halothane (DCI)
- 1,1,1- Trifluoro-2 bromo-2-chloroethane |
2. Propriétés physiques et chimiques
C’est un liquide incolore d’odeur caractéristique, qui ressemble à celle du chloroforme. Le point d'ébullition est à 50°C, ce qui implique une administration sous forme d’aérosol.
En règle générale, l'introduction d'un halogène n'augmente que modérément la polarité de la molécule (en comparaison avec les alcanes).
Les composés halogénés aliphatiques sont des liquides mobiles, volatiles, ininflammables et inertes. L’halothane ne déroge pas à cette règle.
Pour un halogène donné, la volatilité et la densité décroissent lorsque la masse moléculaire s'accroît (c'est-à-dire allongement de la chaîne ou augmentation du nombre d'halogènes) : ceci explique la densité de vapeur (air = 1) de 6,81 et la densité relative du mélange air/vapeur à 20°C (air = 1) de 2, 9.
La grande stabilité de la liaison C1-F induit une meilleure inertie chimique. En revanche, la liaison C2-Br est beaucoup plus instable, et donc sujette à des cassures induites par la lumière.
Action de la lumière sur l’halothane :
hυ
![]()
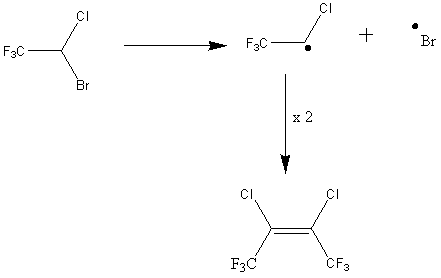
Il convient donc de stocker l’halothane dans un conteneur opaque à la lumière, et le stabiliser par une adjonction de thymol à 0,01 %.
Par ailleurs, la sensibilité à l'oxydation des dérivés halogénés conduit toujours à des produits toxiques (acides halogénés corrosifs). Ils subissent une oxydation radicalaire aboutissant par l'intermédiaire d'un hydroperoxyde à divers produits de réarrangement.
L’halothane est ainsi dégradé en présence de métaux. On ajoute donc des conservateurs pour éviter leur oxydation.
La décomposition thermique (au contact d’une flamme ou d’un métal chauffé au rouge et en présence d’air humide) produit du fluorure d’hydrogène, du fluorure de carbonyle, chlorure d’hydrogène, bromure d’hydrogène et phosgène. L’Halothane est liposoluble, de par les interactions entre les dérivés halogénés et les hydrogènes d’autres molécules. Son coefficient de partage octanol / eau vaut 0,005. Cette indication est à corréler à la Concentration Alvéolaire Minimale (CMA), qui est la concentration minimale nécessaire pour supprimer 50 % de réponse à un stimulus douloureux : plus la lipophilie est importante, plus la CMA est faible.
3. Utilisation
L’Halothane est utilisé comme un anesthésique d’inhalation chez les carnivores. Sa sécurité et son contrôle rapide expliquent son succès, et même son utilisation chez un malade en état de risque urgent.
Rappelons que l’anesthésie générale telle que définie aujourd’hui, consiste en un état d’inconscience induit par une ou plusieurs drogues où le patient ne perçoit ni se souvient des stimuli nociceptifs (Prys-Roberts). Les effets de ces derniers se font sentir bien au-delà de la simple perception (l’abolition de celle-ci associée à l’inconscience et l’amnésie conduit à une anesthésie générale) puisqu’ils vont entraîner des réponses motrices et des réponses émanant du système nerveux autonome (réponses respiratoire, cardio-vasculaire, sudo-motrice et hormonale). Le contrôle de la réponse hormonale (libération des hormones de stress) ne sera rendu possible que par l’addition d’un adjuvant analgésique à l’anesthésique général. L’Halothane n’a pas de propriété analgésique intrinsèque, et ne permet pas à lui seul de réaliser une anesthésie dite « stress-free » en cas d’intervention chirurgicale. Les buts poursuivis alors sont : l’inconscience, l’analgésie, et la myorelaxation.
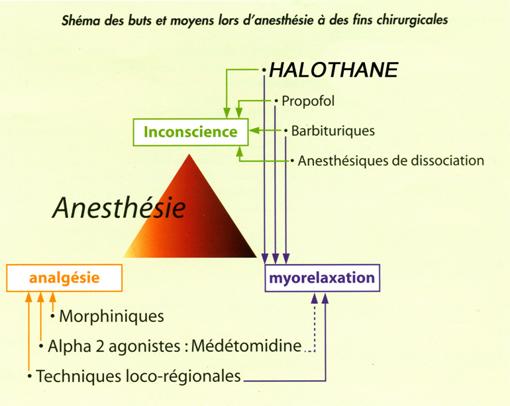
L’Halothane utilisé avec un appareillage adéquat répond aux exigences de l’anesthésie d’urgence :
- rapidité et sécurité de l’induction
- ventilation et oxygénation adéquates
- contrôle et sécurité de l’anesthésie
- réponse rapide à des changements nécessaires dans la narcose
- perturbations minimales des fonctions physiologiques
- cessation rapide des effets après intervention
- simplicité des équipements et des manœuvres
L’anesthésie commence par une induction avec une concentration de 2 à 4 % d’halothane dans l’oxygène ou dans l’air, avec ou sans prémédication (atropine). Par la suite, l’anesthésie est entretenue par une concentration entre 0,5 et 1 %.
II – Métabolisme
Une fois administrés, les anesthésiques volatils subissent, comme tous les médicaments, des processus d’absorption, de distribution, d’interaction ciblée, de métabolisme et d’excrétion. Or, nous pensions autrefois que les anesthésiques inhalés étaient chimiquement inertes. Nous savons maintenant qu’ils subissent un métabolisme significatif et, dans de nombreux cas, une biotransformation en intermédiaires réactifs et potentiellement toxiques. Ces processus métaboliques et chimiques sont affectés par de nombreux facteurs dont le sexe, l’âge, la maladie, les interactions médicamenteuses, l’obésité et, peut-être le plus important, la génétique.
La principale voie d'absorption est la voie respiratoire car l'halothane est très volatile, puis le passage sanguin est rapide (état d'équilibre atteint en 1 heure après le début de l'inhalation).
L'halothane s'accumule dans les tissus graisseux, notamment au niveau du système nerveux central. Là, il l’inhibe à partir du cortex cérébral, et en descendant jusqu’à la moelle épinière. Secondairement il déprime les centres respiratoires, provoque une broncho-dilatation, et abaisse la pression artérielle par inhibition centrale des centres vasomoteurs.
Environ 80 % du produit sont éliminés par voie pulmonaire. Une partie (20 %) de l'halothane est métabolisée selon deux voies:
- une voie mineure réductrice aboutissant à un dérivé halogéné de l'halothane conjugué à une cystéine (qui libère un atome de fluor ionisé par molécule d'halothane éliminée dans les urines)
- une seconde voie oxydative avec libération d'un ion brome, persistant longtemps dans le plasma jusqu'à 10 jours après une exposition unique. Ce métabolisme aboutit à la formation d'un acide trifluroacétique (TFA) mais aussi de N-trifluroacétyl-2-aminoéthanol et 2-N-acétyl-S-[2-bromo-2-chloro-1,1-difuroéthyl]-2-cystéine.
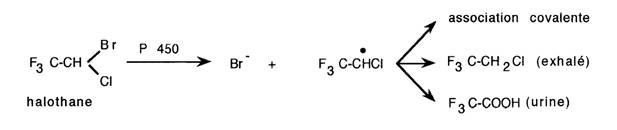
L’halothane subit un métabolisme oxydatif s’exerçant par le cytochrome P450 pour former des métabolites trifluo acétyles haloïdes qui vont produire des protéines hépatiques trifluoroacétylées (TFA). Ces protéines au tissu modifié (haptènes) se forment chez tous les patients exposés.
Chez les individus sensibilisés, ces protéines hépatiques modifiées, pour des raisons encore inconnues, semblent perçues comme non-soi et induisent une réponse immunitaire qui provoque une lésion hépatique et, parfois, la mort du patient. L’hépatite induite par un anesthésique (HIA) représente ainsi une toxicité d’origine immunitaire qui survient chez les individus sensibles après une exposition à un anesthésique volatile.

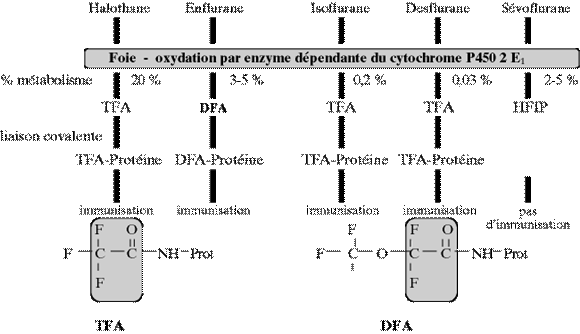
Schéma simplifié du métabolisme des agents halogénés et formation de dérivés immunoréactifs (TFA = acide trifluoroacétique, DFA : acide difluoroacétique) ou non (HFIP = hexafluoroisopropanol).
Une partie de l'halothane est éliminée dans les urines sous forme inchangée et dans l'air expiré (environ 30 % détectable jusqu'à 16 heures après le début de l'inhalation).
La demi-vie sanguine de l'acide trifluoroacétique varie de 50 à 70 heures.
Les métabolites sont éliminés dans les urines et ont tendance à s'accumuler (ils peuvent être détectés jusqu'à 15 jours après une exposition unique).
(Autre que surdosage)
1) Toxicité hépatique
Hépato-toxicité de type I, fréquente, mais controversée se traduit par une dysfonction hépatique transitoire qui peut être reproduite sur des modèles animaux.
Métabolisme → Radicaux libres → Lésions mb → Lésions hépatiques focalisées
Hépato-toxicité de type II, d'origine immunoallergique, exceptionnelle, résulte de la formation d'un métabolite de la voie aérobie : l'acide trifluoroacétique (vu ci-dessus).
TFA-prot → Réponse immunitaire → Hépatite
L’hépatite cytolytique est mortelle dans 50% des cas en l’absence de transplantation. Il survient une asthénie marquée, des nausées et vomissements, et une fièvre inexpliquée. Elle est surtout décrite chez les anesthésistes (fuites dans les circuits d’évacuation des gaz exhalés).
2) Autres
effets
· Effet toxique sur le développement :
- modifications pathologiques néonatales (foie, rein, cerveau)
- diminution de l’ossification fœtale
- diminution de la fertilité
· Effet sur les reins : aucun majeur
· Effet sur les poumons : aucun
· Mutagène (exposition aigüe)
|
TYPES DE RISQUES/ EXPOSITIONS |
RISQUES/ SYMPTOMES AIGUS |
PREVENTION |
PREMIER SECOURS/
|
|
INCENDIE |
Non combustible. Emission de fumées (ou de gaz) irritantes ou toxiques lors d'incendie. |
|
En cas d'incendie à proximité: utiliser les agents d'extinction appropriés. |
|
EXPLOSION |
|
|
En cas d'incendie: maintenir les fûts, etc., à basse température en les arrosant d'eau. |
|
|
|||
|
CONTACT PHYSIQUE |
Avortements. Malformations embryonnaire et fœtales. Diminution de la fertilité. |
OBSERVER UNE HYGIENE STRICTE! EVITER L'EXPOSITION DES FEMMES (ENCEINTES)! |
|
|
· INHALATION |
Confusion. Vertiges. Somnolence. Nausées. Perte de conscience. Migraine. Dépression. |
Ventilation, aspiration locale ou protection respiratoire. |
Air frais, repos. Consulter un médecin. |
|
· PEAU |
Peau sèche. Peau rugueuse. Dermatose |
Gants de protection. |
Retirer les vêtements contaminés. Rincer la peau abondamment à l'eau ou prendre une douche. |
|
· YEUX |
Rougeur. Douleur. |
Lunettes de protection fermées ou protection oculaire associée à une protection respiratoire. |
Rincer d'abord abondamment à l'eau pendant plusieurs minutes (retirer si possible les lentilles de contact), puis consulter un médecin. |
|
· INGESTION |
(Voir Inhalation). |
Ne pas manger, ne pas boire ni fumer pendant le travail. |
Rincer la bouche. NE PAS faire vomir. Consulter un médecin |
IV – Applications : cas clinique d’hyperthermie maligne è Risque d’utilisation de l’halothane
1) Définition
L'hyperthermie maligne (HM) est une maladie autosomale dominante
atteignant des sujets porteurs d'une myopathie infra clinique. C'est une urgence
thérapeutique, pouvant mettre en jeu le pronostic vital. Elle est
caractérisée par un hyper catabolisme des muscles striés (rigidité musculaire
progressive). Elle est déclenchée principalement par les anesthésiques
halogénés.
2) L’animal
- Chatte de race européenne
- Agée de 10 mois
- Motif de la consultation : ovariectomie
3) Examen pré-opératoire : AUCUNE ANOMALIE
4) Commémoratifs et examen post-opératoire
- Animal enfermé durant les 48h qui précèdent l’intervention
- Induction de l’anesthésie par voie veineuse
- Après une intubation trachéale, un relais en anesthésie volatile à l’halothane est assuré jusqu’à la fin de l’intervention chirurgicale.
- Durée de l’intervention : 40 minutes, SANS INCIDENT
- Réveil correct
- 50 minutes plus tard, la chatte est dans un état de conscience altérée,
- Température supérieure à 41,7°C.
- Hypersalivation, détresse respiratoire avec muqueuses cyanosées, hyperesthésie
è Déclaration brutale des symptômes
5) Examens complémentaires
- Electrocardiogramme normal
- Les résultats du prélèvement sanguin indiquent une souffrance musculaire
6) Diagnostic
L’hypothèse majeure est un syndrome d’hyperthermie maligne.
7) Traitement
- Arrêt de l’anesthésie
- Utiliser des myorelaxants
- Diminuer la température corporelle avec de l’eau froide, de la glace.
- Rétablir l’homéostasie
- Gérer la douleur
8) Bilan
Ce syndrome est observé à l’occasion d’une anesthésie générale ou en phase de réveil. L’issue est bien souvent fatale.
La cause de ce syndrome d’HM comprend une grande part de génétique, associée très vraisemblablement à des facteurs environnementaux. Les causes déclenchantes sont les anesthésiques volatiles et certains curares.
Halothane
↓
Modifications des fonctions neuromusculaires : excitation, contraction, métabolisme
↓
Augmentation de la perméabilité des canaux calcium
↓
Libération excessive de calcium
↓
Contracture musculaire
↓
Métabolisme énergétique s’emballe, Production de chaleur
↓
Sensibilité accrue des protéines contractiles au calcium
↓
CERCLE VICIEUX
Il n’existe aucun signe clinique spécifique d’hyperthermie maligne. Cependant, des tests de dépistages existent mais ils sont coûteux, invasifs, peu spécifiques et peu sensibles.
L’hyperthermie maligne fait partie des complications rares mais encore imprévisibles de l’anesthésie générale. C’est un parfait exemple de l’absence de risque zéro en anesthésie qui permet d’insister sur la nécessité d’informer le propriétaire avant tout acte chirurgical sous anesthésie générale.
Conclusion :
|
Indications |
Dose et voie |
Sédation Myorelax. Analgésie |
Effet pharmacologique |
Commentaires |
Métabolisme |
|
- Induction anesthésie
- Maintenance anesthésie |
CN MAC 0,87%
CT MAC 1,14 %
Intra-trachéal |
Importante Légère Aucune |
Dépression SNC |
- Dépression cardiovasculaire dose dépendant
- Sensibilise le cœur aux catécholamines
- Dépression respiratoire
-Bronchodilatation
- Relaxation musculaire
- Hypothermie |
M : Foie (20-50 %)
E : Poumons (forme inchangée) |
D’après La dépêche vétérinaire, supplément n°36, février 1994
CN : chien
CT : chat
MAC : Concentration Alvéolaire Minimale
SNC : Système Nerveux Central
M : lieu de métabolisation
E : principale voie d’excrétion
- A l’heure actuelle, l’Halothane disparaît progressivement de certains pays européens, ce qui pousse sur le devant de la scène un autre anesthésique halogéné : l’Isoflurane. Cette molécule est un dépresseur du système nerveux central. Il provoque l’inconscience, et contribue fortement à la myorelaxation nécessaire pour effectuer la chirurgie. En effet, l’isoflurane présente une élimination sous forme inchangée dans les poumons à plus de 99%, ainsi qu’une rapidité et une réversibilité plus grandes. Par ailleurs, aucun effet de sensibilisation du cœur aux catécholamines n’est observé, et la dépression myocardique est moindre. Cependant l’Isoflurane reste un dérivé halogéné, et à ce titre ne possède pas de propriétés analgésiques intrinsèques. Il faudra donc ajouter un adjuvant analgésique lors d’anesthésies à des fins chirurgicales.
- Gène majeur : Hal. Ce gène a été étudié chez les porcs charcutiers qui, lors d’anesthésies expérimentales à l’halothane, ont déclaré une hyperthermie maligne qui conduit à des lésions musculaires et donc à un défaut de qualité de la viande (PSE). Ce gène est dit « pléiotrope » car il a un effet majeur sur un caractère économiquement important. En présence de ce gène homozygote récessif (nn), malgré la prédisposition au syndrome d’HM, le taux de muscle du porc est le plus élevé. Cette expérience montre donc, en plus de son utilisation chez les carnivores, une importance de l’halothane dans le domaine des productions animales.